Open Access, Peer-reviewed
eISSN 2093-9752

Open Access, Peer-reviewed
eISSN 2093-9752
Youngjae Roh
Hwayoung Park
http://dx.doi.org/10.5103/KJAB.2025.35.3.144 Epub 2025 August 06
Abstract
Objective: This study aimed to identify multidimensional predictors of motor and functional decline in women with Parkinson's disease (PD), providing foundational evidence for developing a tailored intervention program through a preliminary study.
Method: This cross-sectional study included 29 women with idiopathic PD (Hoehn and Yahr stages 1-3 and aged 60-69) and 18 age-matched healthy controls. Assessments covered physical activity levels, physical function tests (5 times Sit-to-Stand, SPPB, and Mini-BESTest), and detailed gait parameters during forward, backward, and turning walking tasks. Between-group differences were analyzed. Within the PD group, nonparametric correlations examined associations between clinical severity (H&Y stage and UPDRS scores) and functional or gait variables. Logistic regression identified key gait predictors distinguishing PD from controls.
Results: PD participants showed significantly lower physical activity scores, slower sit-to-stand performance, reduced 6-minute walk distances, lower SPPB and Mini-BESTest scores, slower gait speeds, shorter stride lengths, and increased double-limb support times (all p < .05). Clinical severity correlated negatively with 6-minute walk distance, gait speed, and stride length, and positively with double-limb support time. Stepwise logistic regression identified stride length during fast-speed outward maneuver turns (Contralateral side) and backward walking (Ipsilateral side) as strong predictors distinguishing PD from controls (AUC ≥ 0.86).
Conclusion: This study identified key multidimensional predictors of functional decline in women with PD, including objective gait predictors associated with disease severity. These findings support the need for tailored intervention programs that specifically target balance, stride length, and turning control to address both motor and nonmotor aspects of PD. Future studies are expected to evaluate the effectiveness of personalized Intervention programs through randomized controlled trials.
Keywords
Parkinson's disease Women Gait Personalized Intervention program Ballet
파킨슨병(Parkinson's disease)은 알츠하이머병(Alzheimer's disease) 다음으로 가장 흔한 신경퇴행성 질환으로 전 세계 약 1,000만명, 국내 약 12만 5천명이 앓고 있으며 인구 고령화와 함께 지속적으로 증가하고 있는 추세이다(National Health Insurance Corporation, 2025; Adhikari & Pokhrel, 2024). 파킨슨병의 병리학적 특징은 기저핵(Basal ganglia) 흑색질 치밀부(Substantia nigra pars compacta)에서 도파민성 신경세포의 점진적인 소실과 흑색질 선조체 경로(Nigro-striatal path- way)의 파괴(Bertoli, Della Croce, Cereatti & Mancini, 2019; Carpinella et al., 2007)에 의한 것이며, 운동 계획 및 실행과 관련된 운동 증상(Motor symptoms)과 인지, 자율신경, 통증과 같은 비운동 증상(Nonmotor symptoms)이 나타난다(Jankovic & Sherer, 2014).
파킨슨병 임상 치료는 질병이 진행될수록 도파민 대체 요법 반응이 둔화되고, 장기간 약물 사용으로 인한 부작용이 나타나, 질병 진행을 늦추거나 완화하는 데는 한계가 존재한다(Behari, Srivastava & Pandey, 2005; Meng et al., 2024; Xu, Gong, Man & Fan, 2014). 따라서 물리 치료 및 신체활동과 같은 비약물적 중재에 대한 관심이 요구된다(Bloem, de Vries, & Ebersbach, 2015; Ekker, Janssen, Nonnekes, Bloem & De Vries, 2016). 이러한 중재 프로그램의 목표는 운동 기능의 재학습 및 자동화된 움직임 전략 회복(Ferrazzoli et al., 2017; Morris et al., 2017; Nieuwboer, Rochester, Müncks & Swinnen, 2009; Wu, Hallett & Chan, 2015)과 신체적 및 심리적 부담으로 인하여 저하된 환자의 건강 관련 삶의 질 개선에 있다(Batista & Pereira, 2016; Opara, Brola, Leonardi & Błaszczyk, 2012). 파킨슨병 환자의 운동 증상은 주로 편측 사지에서 시작하여 점진적으로 진행되며, 후기 단계에서 양측으로 심화된다(Monje et al., 2021). 이러한 비대칭적 운동 증상의 악화는 상지와 하지 모두 영향을 미쳐 자세 불안정으로 인한 제어 능력 저하와 함께 넘어짐 발생률 증가로 이어진다(Canning, Allen, Dean, Goh & Fung, 2012; Rocchi, Chiari & Horak, 2002). 이를 극복하기 위한 선행 연구에 의하면, 파킨슨병 환자들의 태극권, 스트레칭, 트레드밀, 점진성 저항 운동 프로그램 적용이 체력, 보행 능력, 균형, 근력 강화뿐 아니라 뇌신경 가소성을 촉진하여 도파민 신호 전달 및 시냅스 강화를 통한 운동 증상의 개선에 영향을 미치는 것으로 보고되었다(Fisher et al., 2004; Gronek et al., 2021; Khobkhun et al., 2021; Li et al., 2012; Petzinger et al., 2007; Silva-Batista et al., 2020; Schenkman et al., 2018; Youm et al., 2020).
그러나 파킨슨병 환자들이 겪는 대부분의 증상은 운동 증상뿐 아니라 인지 기능 저하, 우울, 불안 등 다양한 비운동 증상도 함께 나타나며 이는 삶의 질 저하, 넘어짐 위험 증가 등과 밀접하게 관련된다. 그럼에도 불구하고, 현재 대부분의 파킨슨병 치료 접근 및 중재 전략은 도파민 기반 약물 요법 및 운동 증상 완화에 초점을 맞추고 있어(LeWitt & Chaudhuri, 2020; Pfeiffer, 2016; Politis et al., 2010), 이들의 비운동 증상까지 포괄하는 중재 프로그램에 대한 연구는 여전히 부족한 실정이다. 이러한 한계를 보완하기 위한 대안으로 다양한 예술 기반의 신체활동 프로그램이 제안되었으며, 특히 춤을 비롯한 예술 기반 프로그램이 파킨슨병 환자의 균형, 유연성, 손놀림 기술(Manual dexterity), 보행 및 회전 능력과 같은 운동 증상뿐 아니라 실행 능력(Executive function), 공간 인지(Spatial cognition), 기억력(Memory), 집중력(Attention) 등의 비운동 증상 개선에도 긍정적인 영향을 미친다고 보고된 바 있다(Carapellotti, Stevenson & Doumas, 2020; Lötzke, Ostermann & Büssing, 2015). 그 중에서도 무용 프로그램은 신체적 요소뿐 아니라 주의력, 기억력, 다양한 인지 처리 과정에 관여하는 다차원적이고 감각적인 경험을 포함하고 있으며(Verghese et al., 2002), 특히 발레는 신체 조절력, 유연성, 정서 표현력, 심리적 자기효능감 등 파킨슨병 환자의 운동 및 비운동 증상을 동시에 개선할 수 있는 접근으로 효과 있는 것으로 보고되었다(Roh, 2024; Park, 2020; Shin, 2020; Lee, 2022; Houston & McGill, 2013; Podlewska et al., 2024). Podlewska 등 (2024)에 따르면, 2009년 영국국립발레단(English National Ballet)이 파킨슨병 환자들을 위한 발레 기반 중재 프로그램을 실시한 결과, 환자들의 운동 증상뿐 아니라 정서적, 사회적, 예술적 측면에서도 긍정적인 효과가 나타났으며, 향후 파킨슨병 환자의 발레 기반 중재 프로그램의 치료 효과를 보다 명확히 검증하기 위한 무작위 대조 시험(Randomised controlled trial) 연구의 필요성을 강조하였다.
그럼에도 불구하고, 기존 연구들은 대상자 수가 제한적이거나, 무작위 대조 시험 설계가 부족하고, 주로 운동 증상에 국한되어 있어 파킨슨병의 운동 및 비운동 증상을 포괄적으로 평가한 연구가 여전히 미흡한 실정이다. 이에 본 연구는 향후 발레 기반 중재 프로그램을 적용하기 위한 실험 설계 전단계로써, 여성 파킨슨병 환자의 운동 증상 및 기능적 저하를 객관적으로 규명하고자 하는 기초 연구이며, 예술 기반 중재 프로그램이 향후 유용한 파킨슨병의 치료 전략이 될 수 있는 가능성에 대한 간접적 근거를 제공하는데 초점을 둔다. 따라서 본 연구의 목적은 경증에서 중증 단계에 해당하는 60-69세의 여성 파킨슨병 환자를 대상으로 건강 대조군 간의 임상 특성, 신체활동 점수, 신체 기능 평가, 보행 특성의 비교를 통해 파킨슨병의 증상 진행 양상의 이질성을 탐색하고, 질병의 운동 증상 및 기능적 저하를 가장 잘 반영할 수 있는 핵심 예측 요인을 도출하는 것이다. 이러한 사전 연구의 결과는 향후 파킨슨병 환자의 맞춤형 중재 프로그램 개발을 위한 과학적, 객관적 근거를 제공할 것으로 기대된다.
1. 연구 대상자
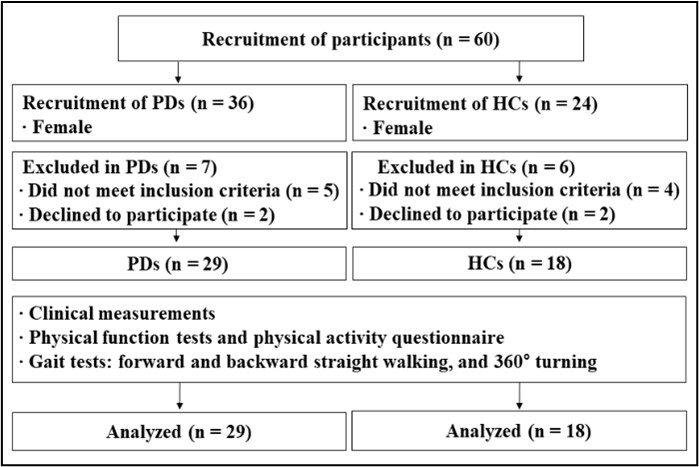
연구 대상자는 신경과 전문의에게 UK Parkinson's Disease Society Brain Bank의 기준에 따라(Hughes, Daniel & Lees, 2001) 특발성 파킨슨병을 진단받은 여성 환자 29명과 동연령대 건강한 여성 대조 그룹 18명을 모집하였다(Figure 1. 참조). 연구 대상자의 선정기준은 60-69세 여성, 스스로 보행 및 이동이 가능하고, 한국형 간이인지 기능검사(Korean Mini Mental State Examination, K-MMSE) 24점 이상(Kang, Na & Hahn, 1997)인 대상자, 수정된 Hoehn & Yahr (H&Y) 1-3단계(Goetz et al., 2004; Hoehn & Yahr, 1967; Martinez-Martin et al., 2018), 항파킨슨병 약물에 안정적으로 반응하는 환자로 선정하였다. 연구 대상자의 제외기준은 심혈관계, 근골격계, 전정기관 또는 다른 신경학적 장애 병력을 가졌거나 이동하는 동안 보조기구를 사용해야 하는 환자, 약에 의해 통제할 수 없는 운동이상증을 가진 환자로 하였다. 동연령대 여성 대조 그룹은 최근 6개월 동안 인지 장애 및 보행 장애와 관련된 병력이 있거나 정형외과적으로 수술을 받은 대상자는 제외하였다(Table 1. 참조). 이 연구는 실험과 관련된 모든 절차에 관하여 실험 전 동아대학교 의료원 임상윤리위원회(The Institutional Review Board)의 심의를 받았으며(DAUHIRB-22-089), 연구 대상자는 심의 결과에 따라 승인된 실험동의서에 대해 충분한 설명을 받은 후 서명하였다. 또한 이 연구는 한국 질병관리청 임상연구정보서비스(The Clinical Research Information Service)에 등록되어 관련 지침 및 규정을 준수하였다(KCT0009353).
|
Characteristics |
People with |
Healthy |
p-value |
|
Age (years) |
65.10±2.55 |
63.33±2.93 |
.034a |
|
Height (cm) |
154.77±5.15 |
156.17±3.32 |
.311a |
|
Weight (kg) |
57.73±8.59 |
59.21±6.99 |
.544a |
|
BMI (kg/m2) |
24.07±3.19 |
24.25±2.47 |
.839a |
|
K-MMSE |
28.21±1.45 |
27.39±1.72 |
.087b |
|
H&Y
scale (1/2/3) |
10/11/8 |
- |
- |
|
UPDRS total |
44.60±19.22 |
- |
- |
|
UPDRS part III |
24.29±12.78 |
- |
- |
|
Note. The data are presented as mean ± standard
deviation, with significant differences between groups indicated in bold (p < .05). aIndependent samples
t-test result, bMann-Whitney
U test result |
|||
2. 실험 장비 및 절차
이 연구의 신체 기능 평가 중 악력과 6분 걷기 측정을 위한 실험 장비는 등척성 디지털 악력계(TKK 5401 Grip-D, Takei Scientific Instruments, Tokyo, Japan), 초시계, 고깔, 줄자 등을 사용하였다. 또한 보행 측정을 위한 실험 장비는 3D 모션 데이터 분석을 위해 9대의 적외선 카메라(Vicon MX-T10, Oxford Metrics, UK)와 Nexus software (version 2.12.0; Oxford Metrics, UK)를 이용하였으며, 실험에 사용되는 장비 및 분석 프로그램의 특성은 <Table 2>와 같다. 실험 장비 배치는 직선 걷기 및 회전 과업 측정 시 동작이 충분히 관찰될 수 있는 실험실 중앙의 8 m 보행로 전체를 포함할 수 있도록 주위에 적외선 카메라를 배치하였다(Figure 2. 참조).
|
Equipment |
Model |
Manufacturer |
|
Isometric
digital |
TKK
5401 Grip-D |
Takei
Scientific |
|
Infrared camera |
Vicon MX-T10 |
Vicon (UK) |
|
Synchronizer |
Giganet |
Vicon (UK) |
|
Analysis S/W |
Nexus |
Vicon (UK) |
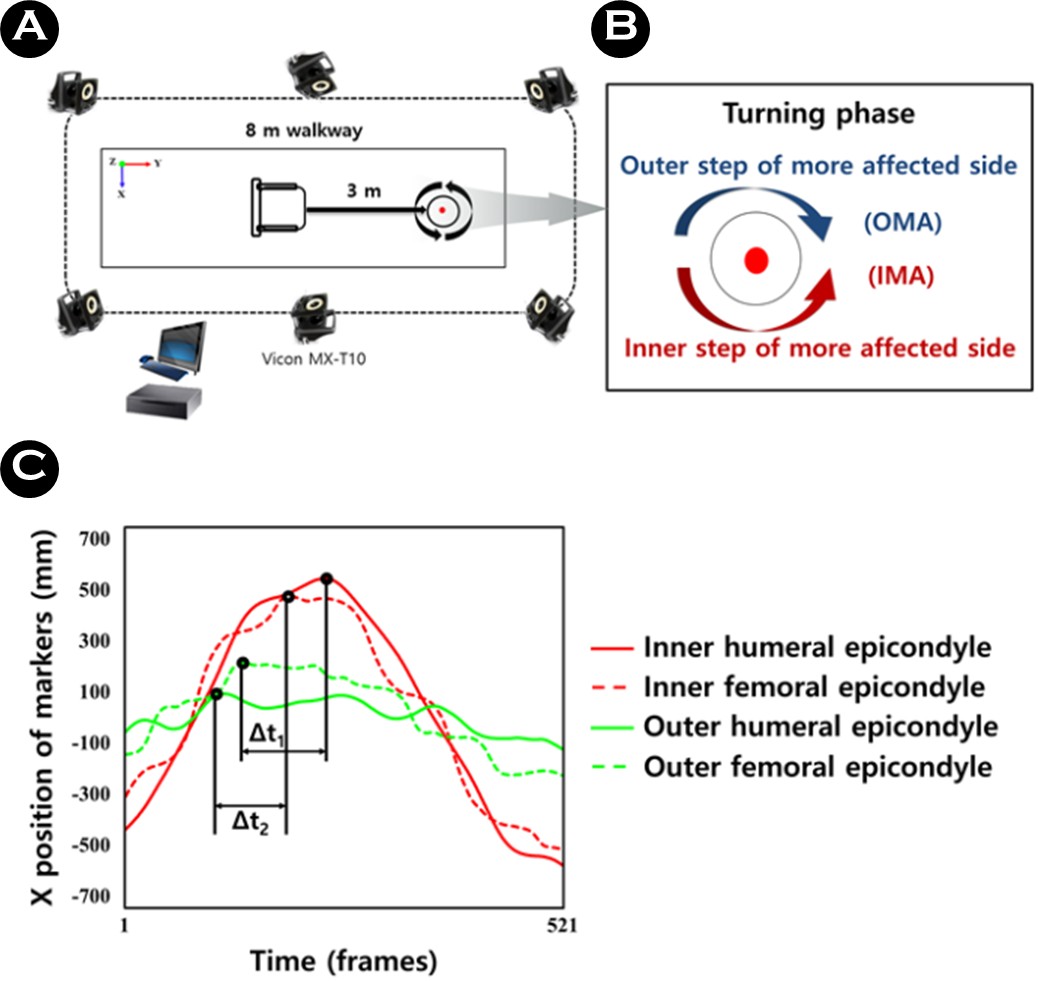
파킨슨병 환자들의 모든 측정은 항파킨슨병 약물 효과를 충분히 느낄 수 있는 복용 후 약 2-3시간이 지난 "On" 상태에서 실시하였다(Willemssen, Müller, Schwarz, Hohnsbein & Falkenstein, 2008). 대부분의 파킨슨병 환자는 항파킨슨병 약물을 복용한 상태에서 일상생활 활동을 하기 때문에 이들의 가장 자연스러운 보행 특성을 확인할 수 있다(Plotnik, Giladi, Dagan & Hausdorff, 2011).
첫 번째 실험 과정은 신경과 전문의 및 간호사와 함께 연구 대상자의 실험동의서 작성, 파킨슨병 장애평가척도(Unified Parkinson Disease Rating Scale, UPDRS) 검사(Goetz et al., 2008; Park et al., 2020), 수정된 H&Y 검사(Goetz et al., 2004; Hoehn & Yahr, 1967; Martinez-Martin et al., 2018), K-MMSE 검사(Kang et al., 1997)와 같은 임상 특성과 신체활동 설문지(International physical activity questionnaire, IPAQ) (Craig et al., 2003)를 작성하였다(Table 1. 참조). 두 번째 실험 과정은 신체 기능 평가와 보행 측정을 실시하였으며, 운동학 전문가인 훈련된 평가자는 대상자의 그룹을 모르는 블라인드(blinded) 상태에서 평가를 진행하였다. 또한, 평가의 일관성을 유지하기 위해 사전 표준화된 프로토콜에 대한 일관된 교육 및 동일한 환경에서 수행되었다. 평가 전 모든 연구 대상자들의 신체적 특성 측정 및 약 5분 간 준비운동을 실시하였으며, 좌우 악력(Grip strength) (American Society of Hand Therapists, 1992), 5회 앉은 자세에서 일어서기(Five times sit-to-stand) (Bohannon, 2006), 6분 걷기(Six min walking) (Enright, 2003), 간편 신체수행 검사(Short physical performance battery, SPPB) (Guralnik et al., 1994), 균형 능력 평가 검사(Mini-balance evaluation systems test, Mini-BEST) (Franchignoni, Horak, Godi, Nardone & Giordano, 2010)를 실시하였다. 좌우 악력은 등척성 디지털 악력계(TKK 5401 Grip-D, Takei Scientific Instruments, Tokyo, Japan)를 이용하여 상지 근력을 평가하고, 앉은 자세에서 일어서기는 최대한 빠르게 5회 수행한 시간을 측정하여 하지 근력을 평가하였다. 6분 걷기는 20 m 거리의 양 끝에 배치된 고깔을 최대한 빠르게 6분 간 걸은 거리를 측정하여 심폐지구력을 평가하였다. SPPB 검사는 하지 근력, 균형, 보행 능력을 종합적으로 평가하여 신체 기능 저하 여부를 판단하였으며, Mini-BEST는 자세 조절과 관련한 균형 능력을 종합적으로 평가하였다.
보행 측정은 자가 선호 속도(Preferred speed, PS)로 전방(Forward) 및 후방 직선 걷기(Backward straight walking), 360° 회전 과업을 실시하였으며, 모든 측정은 약 2회 정도 연습을 실시하였다. 360° 회전 과업은 일상생활에서 걷는 자가 선호 속도와 가능한 빠르게 일어서서 걷는 최대 속도(Fast speed, FS)로 환측(More-affected side, MAS)과 건측(Less-affected side, LAS) 방향 회전으로 실시하였다. 구체적으로, 회전 시 환측이 안쪽일 경우(Inner step of the more-affected side, IMA)와 바깥쪽일 경우(Outer step of the more-affected side, OMA) 두 방향으로 수행하였다(Park et al., 2021). 이러한 이유는 대부분의 파킨슨병 환자들은 증상 영향을 더 받은 환측이 안쪽으로 회전을 수행할 때 더 큰 어려움을 겪는 것으로 나타난 선행 연구 결과에 기반한 것이다(Park et al., 2021; Park, Shin, Youm & Cheon, 2024). 모든 연구 대상자들의 환측에 대한 회전 방향은 신경과 전문의에 의해 분류되었다(Figure 2. 참조). 모든 보행 과업은 각각 3회의 무작위 순서로 측정하였으며, 연구 대상자의 컨디션 조절과 피로를 예방하기 위해 1회 동작 후 약 30초의 휴식을 취하도록 하였다.
모든 연구 대상자들은 보행 측정 시 스판 소재의 티셔츠와 반바지를 착용하였으며, 실험 동작은 맨발로 실시하였다. 각 관절의 운동학 자료 산출을 위한 측정은 연구 대상자의 어깨 두께(Shoulder offset), 팔꿈치 너비(Elbow width), 손목 너비(Wrist width), 손바닥 두께(Hand thickness), 다리 길이(Leg length), 무릎 너비(Knee width), 발목 너비(Ankle width)를 줄자와 캘리퍼(Calliper)를 이용하여 측정하였다. 신체 모델은 Helen Hayes Marker Set을 수정한 Plug in Gait Full Body Model (Davis & Katz, 1992)에 따라 14 mm 구형 반사마커 39개를 부착하여 구성하였다(Park et al., 2021).
3. 자료 수집 및 처리
신체 기능 평가는 훈련된 평가자가 표준화된 프로토콜을 사용하여 대상자에게 검사를 안내하고, 수행 수준에 따라 점수를 부여하고, 엑셀 파일에 코딩하여 수집하였다. 전방 및 후방 직선 걷기 및 360° 회전 과업 측정 시 수집한 3D 모션 데이터는 Nexus software와 MATLAB R2017b (MathWorks, Natick, MA)을 사용하여 수집 및 처리하였다. 모든 보행 측정을 위한 샘플링 주파수는 100 Hz로 실시하였으며, 수집된 자료는 Butterworth low-pass filter 4차, 영상 자료 10 Hz로 필터링하였다(Jones, James, Thacker, Jones & Green, 2016). 모든 측정에서 각각 3회 반복하여 수집한 자료는 이를 평균한 값으로 산출 및 분석하였다.
보행 측정의 분석 변인은 전방 및 후방 직선 걷기 시 평균 보행 속도(Average walking speed, WS), 스트라이드 길이(Stride length, SL), 양하지 지지구간(Double support phase, DSP)과 같은 시공간 변수, 360° 회전 과업 시 시공간 변수와 운동학 변수인 상하지 대측 시간적 협응(Contralateral tem- poral coordination, CTC) 변수를 분석하였다(Park et al., 2021). 스트라이드 길이 변수는 좌우 각각 초기 발 뒤꿈치 접촉과 같은 발의 초기 발 뒤꿈치 접촉 사이의 수직 거리로 정의되며, 양하지 지지구간 변수는 보행 동안 좌우 발이 모두 지면에 접촉하는 시기로 정의하였다. 상하지 대측 시간적 협응 변수는 360° 회전 과업 시 환측이 안쪽-바깥쪽/바깥쪽-안쪽의 외측 상완골 상과(팔꿈치)와 외측 대퇴골 상과(무릎) 마커를 기준으로 피크(Peak) 사이의 시간적 차이(Δt)로 계산되었다(Figure 2. 참조).
4. 통계 분석
이 연구의 모든 수집 및 분석 자료는 정규성 검정을 위하여 Shapiro-Wilk 검정을 실시하였으며, 정규분포를 따르는 경우 독립표본 t-검정, 정규분포를 따르지 않는 경우 Mann-Whitney U 검정을 적용하였다. 모든 연구 대상자의 인구학적 및 임상적 특성(Table 1. 참조), 신체활동 설문 점수, 신체 기능 평가, 보행 측정 변수에 대한 평균 및 표준편차, 그룹 간 차이(Table 2. 참조) 분석하기 위해 독립표본 t-검정 또는 Mann-Whitney U 검정을 사용하였다.
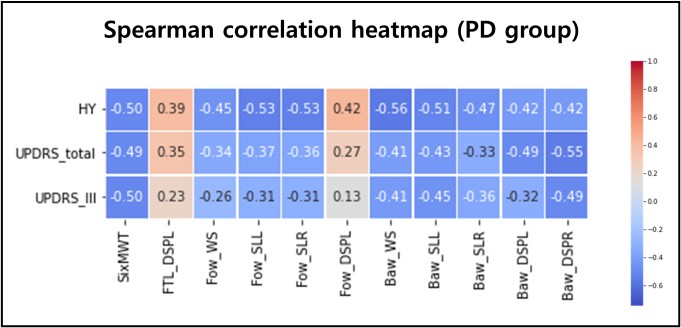
상관분석은 파킨슨병 환자 그룹 내 연속형 변수 간의 비선형 관계를 고려하여 비모수적 분석 방법인 Spearman의 순위 상관계수(Spearman's rank correlation coefficient, ρ)를 기반으로 하였다. 환자의 임상 특성과 신체활동 점수, 신체 기능, 보행 변수 간의 상호 연관성을 확인하기 위해 변수들에 대한 상관계수 및 유의확률을 계산한 후, 환자의 임상 특성과 유의한 차이가 나타난 변수들을 기반으로 상관계수 행렬을 히트맵(Heatmap)으로 시각화하였다(Figure 3. 참조).
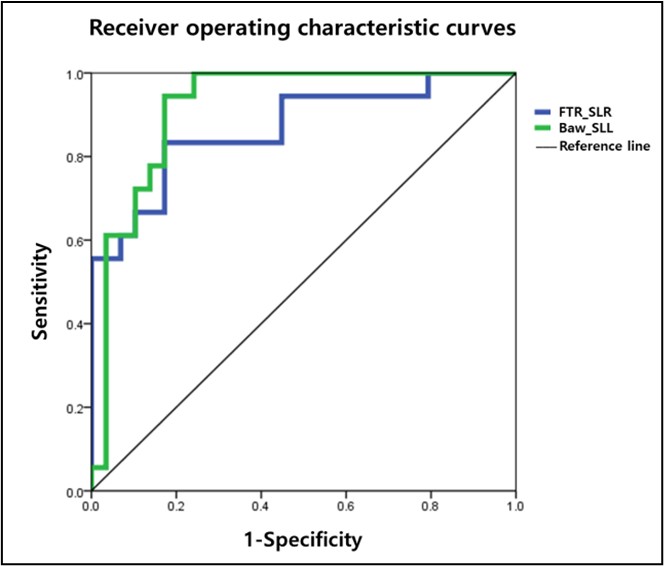
단계적 이원 로지스틱 회귀 분석(Stepwise binary logistic regression analysis)은 대조 그룹으로부터 파킨슨병 환자를 가장 잘 구별하는 주요 예측 요인을 식별하기 위해 모든 변수들의 Z-표준화를 수행한 후 실시하였다. 분류 변수들은 95% 신뢰구간 내 하한 값과 상한 값의 범위와 함께 승산비(Odds ratios, OR)를 제시하였다. 또한, 수신자 작용 특성 곡선(Receiver operating characteristic curve, ROC curve) (Figure 4. 참조)을 이용하여 Youden's index로 계산된 컷오프 값을 도출하였으며, 분류 모형의 성능을 평가하기 위해 AUC 값을 제시하였다(Table 3. 참조). 모든 통계 분석은 SPSS 22.0 (SPSS Inc., Chicago, IL)을 이용하였으며, 추가적인 데이터 전처리 및 분석은 Pandas, NumPy, Seaborn, and Matplotlib을 포함한 라이브러리와 함께 Python (version 3.10)을 이용하여 수행하였다. 모든 자료의 통계적 유의수준은 .05로 설정하였다.
|
Characteristics |
People with PD (n = 29) |
Healthy controls (n = 18) |
p-value |
|
IPAQ (score) |
2894.92±6362.80 |
3721.17±2945.25 |
.013b |
|
Grip strength (Left) |
21.69±4.05 |
22.24±3.26 |
.606a |
|
Grip strength (Right) |
22.68±4.06 |
23.67±4.13 |
.427a |
|
Five times sit-to-stand (sec) |
8.75±2.34 |
6.58±1.33 |
<.001b |
|
Six min walking (m) |
528.25±751.16 |
489.32±36.27 |
<.001b |
|
SPPB (score) |
11.14±1.79 |
12.00±0.00 |
.010b |
|
Mini-BEST (score) |
23.48±2.86 |
25.78±1.56 |
<.001a |
|
Forward_WS (m/sec) |
0.93±0.17 |
1.16±0.15 |
<.001a |
|
Forward_SL_MAS (m) |
1.00±0.13 |
1.18±0.08 |
<.001a |
|
Forward_SL_LAS (m) |
1.01±0.14 |
1.18±0.07 |
<.001a |
|
Forward_DSP_MAS (%) |
25.91±4.27 |
21.95±3.26 |
<.001a |
|
Forward_DSP_LAS (%) |
26.02±4.31 |
21.97±2.66 |
<.001a |
|
Backward_WS (m/sec) |
0.49±0.18 |
0.80±0.13 |
<.001b |
|
Backward_SL_MAS (m) |
0.56±0.16 |
0.84±0.10 |
<.001a |
|
Backward_SL_LAS (m) |
0.56±0.17 |
0.83±0.08 |
<.001a |
|
Backward_DSP_MAS (%) |
31.45±25.91 |
50.75±30.17 |
.049b |
|
Backward_DSP_LAS (%) |
29.10±26.74 |
57.41±32.40 |
.009b |
|
PS_IMA_Turn_WS (m/sec) |
0.67±0.11 |
0.87±0.20 |
<.001a |
|
PS_IMA_Turn_SL_MAS (m) |
0.65±0.11 |
0.80±0.18 |
<.001a |
|
PS_IMA_Turn_SL_LAS (m) |
0.79±0.11 |
0.93±0.17 |
<.001a |
|
PS_IMA_Turn_DSP_MAS (%) |
39.73±5.23 |
31.55±6.22 |
<.001a |
|
PS_IMA_Turn_DSP_LAS (%) |
39.05±5.81 |
30.52±5.46 |
<.001b |
|
PS_IMA_Turn_CTC_MAS (sec) |
0.34±0.04 |
0.34±0.05 |
.911a |
|
PS_IMA_Turn_CTC_LAS (sec) |
0.34±0.03 |
0.32±0.04 |
.358a |
|
PS_OMA_Turn_WS (m/sec) |
0.66±0.12 |
0.85±0.19 |
.001a |
|
PS_OMA_Turn_SL_MAS (m) |
0.74±0.08 |
0.93±0.15 |
<.001a |
|
PS_OMA_Turn_SL_LAS (m) |
0.62±0.11 |
0.76±0.17 |
.001a |
|
PS_OMA_Turn_DSP_MAS (%) |
38.29±5.61 |
31.58±5.69 |
<.001a |
|
PS_OMA_Turn_DSP_LAS (%) |
38.73±5.70 |
31.78±5.18 |
<.001a |
|
PS_OMA_Turn_CTC_MAS (sec) |
0.32±0.04 |
0.33±0.04 |
.727a |
|
PS_OMA_Turn_CTC_LAS (sec) |
0.34±0.05 |
0.36±0.03 |
.710b |
|
FS_IMA_Turn_WS (m/sec) |
0.80±0.15 |
1.02±0.21 |
<.001a |
|
FS_IMA_Turn_SL_MAS (m) |
0.66±0.11 |
0.78±0.18 |
.018a |
|
FS_IMA_Turn_SL_LAS (m) |
0.81±0.11 |
0.89±0.15 |
.075a |
|
FS_IMA_Turn_DSP_MAS (%) |
35.07±4.87 |
29.43±4.94 |
<.001a |
|
FS_IMA_Turn_DSP_LAS (%) |
33.58±5.63 |
28.80±5.17 |
.005a |
|
FS_IMA_Turn_CTC_MAS (sec) |
0.36±0.04 |
0.34±0.04 |
.194a |
|
FS_IMA_Turn_CTC_LAS (sec) |
0.31±0.03 |
0.31±0.02 |
.645a |
|
FS_OMA_Turn_WS (m/sec) |
0.76±0.12 |
1.02±0.18 |
<.001a |
|
FS_OMA_Turn_SL_MAS (m) |
0.80±0.10 |
0.93±0.14 |
.002a |
|
FS_OMA_Turn_SL_LAS (m) |
0.62±0.08 |
0.79±0.14 |
<.001a |
|
FS_OMA_Turn_DSP_MAS (%) |
34.16±4.91 |
27.43±5.49 |
<.001a |
|
FS_OMA_Turn_DSP_LAS (%) |
35.86±5.31 |
28.21±5.37 |
<.001a |
|
FS_OMA_Turn_CTC_MAS (sec) |
0.33±0.02 |
0.31±0.03 |
.040b |
|
FS_OMA_Turn_CTC_LAS (sec) |
0.35±0.03 |
0.36±0.03 |
.174a |
|
Note. The data are presented
as mean ± standard deviation, with significant
differences between groups indicated in bold (p < .05). aIndependent
samples t-test result, bMann-Whitney
U test result PD:
Parkinson's
disease, IPAQ: International physical activity questionnaire, SPPB: Short
physical performance battery, Mini-BEST: Mini-balance evaluation systems
test, Forward: Forward straight walking, Backward: Backward straight walking,
WS: Average walking speed, SL: Stride length, DSP:
Double support phase, PS: Preferred speed, FS: Fast speed, IMA: Inner step of
the more-affected side, OMA: Outer step of the more-affected side, Turn: 360° turning, CTC: Contralateral
temporal coordination, MAS: More-affected side, LAS: Less-affected side |
|||
1. 파킨슨병 환자와 건강한 대조 그룹 간 차이
파킨슨병 환자와 대조 그룹 간 신체활동 점수, 신체 기능, 보행 관련 변수에 대한 다음과 같은 특성 차이가 나타났다(Table 3. 참조). 파킨슨병 환자는 대조 그룹에 비해 유의하게 낮은 신체활동 점수(p = .013), 증가된 5회 앉은 자세에서 일어서기 시간(p < .001)과 6분 걷기 거리(p < .001), 낮은 SPPB (p = .010)와 Mini-BEST 점수(p < .001), 감소된 평균 보행 속도(전방 및 후방 걷기, 선호/빠른 속도 IMA/OMA 회전 모두 p < .001), 짧은 스트라이드 길이(전방 및 후방 걷기, 선호 속도 OMA 회전 시 환측 및 건측, 빠른 속도 OMA 회전 시 건측 p < .001, 선호 속도 OMA 회전 시 건측 p = .001, 빠른 속도 IMA 회전 시 환측 p = .018, 빠른 속도 OMA 회전 시 환측 p = .002), 증가된 양하지 지지구간(전방 걷기, 선호 속도 IMA/OMA 회전 시 환측 및 건측 p < .001, 후방 걷기 시 환측 및 건측 각각 p = .049, p = .009, 빠른 속도 IMA 회전 시 환측 및 건측 각각 p < .001, p = .005, 빠른 속도 OMA 회전 시 환측 및 건측 p < .001), 지연된 대측 시간적 협응(빠른 속도 OMA 회전 시 환측 p = .040)이 나타났다.
2. 파킨슨병 환자의 임상 및 보행 변수 간 상관관계
파킨슨병 환자 그룹 내에서 H&Y 단계, UPDRS total 및 part III 점수를 포함한 임상 특성과 신체활동 점수, 신체 기능, 보행 변수 간의 상호 연관성을 확인하기 위해 Spearman의 순위 상관계수를 기반으로 비모수적 상관분석을 수행하였다. 그 결과, 6분 걷기 거리는 H&Y 단계, UPDRS total 및 part III 점수 모두와 유의한 음의 상관관계(각각 ρ = -0.50, -0.49, -0.50)가 나타났다. 전방 걷기 시 평균 보행 속도, 스트라이드 길이(환측 및 건측) 변수는 H&Y 단계와 유의하게 음의 상관관계(각각 ρ = -0.45, -0.53, -0.53), 양하지 지지구간(환측) 변수는 유의한 양의 상관관계(ρ = 0.42)가 나타났다. H&Y 단계, UPDRS total 및 part III 점수 모두 후방 걷기 시 평균 보행 속도(각각 ρ = -0.56, -0.41, -0.41), 스트라이드 길이(환측)(각각 ρ = -0.51, -0.43, -0.45), 양하지 지지구간(건측)(각각 ρ = -0.42, -0.55, -0.49) 변수와 유의한 음의 상관관계가 나타났다. 또한, 후방 걷기 시 스트라이드 길이(건측) 변수는 H&Y 단계와 유의한 음의 상관관계가 나타났으며(ρ = -0.47), 양하지 지지구간(환측) 변수는 H&Y 단계, UPDRS total 점수와 유의한 음의 상관관계가 나타났다(각각 ρ = -0.42, -0.49). 이와 같이 유의한 차이가 나타난 상관계수 행렬은 시각화된 히트맵 형태로 제시하였다(Figure 3. 참조).
3. 단계적 이원 로지스틱 회귀 분석을 이용한 주요 예측 요인 식별
파킨슨병 환자와 대조 그룹을 가장 잘 분류할 수 있는 주요 예측 요인을 식별하기 위해 단계적 이원 로지스틱 회귀 분석을 수행하였다(Table 4. 참조). 빠른 속도 OMA 회전 시 스트라이드 길이(건측) (Cutoff value: 0.68 m, sensitivity: 0.833; specificity: 0.828, AUC: 0.868, p < .001)와 후방 걷기 시 스트라이드 길이(환측) (Cutoff value: 0.72 m, sensitivity: 0.944; specificity: 0.828, AUC: 0.920, p < .001)가 길수록 파킨슨병 환자로 분류하는 데 기여함을 나타냈다(Figure 4. 참조).
|
Characteristics (Cut-off value) |
OR (95% CI) |
B
(SE) |
p-value |
RN2 |
|
FS_OMA_Turn_SL_LAS (0.68 m) |
9.317 (1.506-57.654) |
2.232 (0.930) |
.016 |
0.800 |
|
Backward_SL_MAS (0.72 m) |
19.633 (2.270-169.763) |
2.977 (1.101) |
.007 |
|
|
Constant term |
0.269 |
-1.315 (0.728) |
.071 |
|
|
Significant differences
indicated in bold (p < .05). OR:
Odds ratios, B: Logistic regression coefficient, SE: Standard error, 95% CI:
95% confidence interval, RN2 is the fit statistic for
the Nagelkerke Model, FS: Fast speed, OMA: Outer step of the more-affected side,
Turn: 360° turning, SL: Stride length, LAS: Less-affected
side, Backward: Backward straight walking, MAS: More-affected side |
||||
본 연구는 60-69세의 여성을 대상으로 경증에서 중증 단계의 파킨슨병 환자와 건강 대조군 간의 임상 특성, 신체활동 점수, 신체 기능 평가, 보행 특성을 비교 분석하였으며, 파킨슨병 환자 그룹 내 임상 특성과 보행 변수 간 상관관계를 평가하고, 이들을 기반으로 건강 대조군으로부터 파킨슨병 환자를 구별할 수 있는 주요 예측 요인을 식별하여 향후 맞춤형 중재 프로그램 개발에 필요한 과학적, 객관적 근거를 제공하고자 하였다.
먼저, 파킨슨병 환자는 건강 대조군에 비해 신체활동 점수, SPPB, Mini-BEST 점수가 유의하게 낮게 나타났으며, 5회 의자 앉았다 일어서기 수행 시간과 6분 걷기 거리에서도 뚜렷한 기능 저하를 보였다. 이러한 결과는 파킨슨병 환자의 신체활동 수준 및 신체 기능의 저하를 나타내며, 특히 근력, 균형, 심폐지구력의 전반적인 감소는 질병의 특성인 운동 장애와 밀접한 관련이 있다(Van der Kolk & King, 2013). Martignon 등 (2021)의 연구 결과에 따르면, 신체적 기능 측면에서 중등도의 활동적인 파킨슨병 환자는 골격근 수축력 증가로 인한 하지 근력의 유지가 관찰되었으며, 이는 질병으로 인한 신경근 손상을 일정 부분 상쇄할 수 있음을 보고하였다(Martignon et al., 2021). 이는 향후 맞춤형 중재 프로그램 설계 시, 전반적 근기능(Muscle function)과 근육의 생리적 수축 능력(Muscle contractility) 향상뿐 아니라(Martignon et al., 2021), 보행과 균형 기능 개선에 초점을 맞춘 운동 구성 요소를 중점적으로 고려할 필요가 있음을 강조한다(Van der Kolk & King, 2013). 또한, 전방 및 후방 걷기와 선호 속도 및 빠른 속도 회전 시 파킨슨병 영향을 받은 환측을 안쪽과 바깥쪽으로 회전하는 과업(IMA/OMA 방향 회전)에서 평균 보행 속도 및 스트라이드 길이 감소, 양하지 지지구간 증가, 대측 시간적 협응 지연과 같은 회전 보행 특성은 파킨슨병의 운동 완서, 자세 불안정, 보행 협응 능력 저하와 같은 주요 운동 증상과 밀접한 관련성이 있다(Plotnik, Giladi, & Hausdorff, 2009). 이는 회전 관련 보행 특성 분석이 파킨슨병의 중증도를 평가하고 질병 진행 및 중재 치료 효과를 민감하게 모니터링하는 데 유용한 지표로 활용될 수 있음을 시사한다(Mancini et al., 2025).
파킨슨병 그룹 내 상관분석 결과, 질병 심각도 지표인 H&Y 단계, UPDRS total 및 part III 점수가 증가할수록 6분 걷기 거리, 전방 및 후방 걷기의 평균 보행 속도와 스트라이드 길이가 감소하는 경향을 나타냈으며, 양하지 지지구간 변수와도 유의한 양의 상관관계를 보였다. 이러한 결과는 질병 진행에 따라 운동 장애가 심화되며, 이로 인하여 보행 능력 저하 및 자세 불안정이 증가한다는 선행 연구들의 결과와 일치한다(Van der Heeden et al., 2016; Palakurthi & Burugupally, 2019). 따라서 임상적으로 이러한 보행 능력 특성을 활용하기 위해서는 향후 보다 정교한 모델링과 종단적 연구를 통하여 파킨슨병의 진행 정도 및 중증도를 효과적으로 평가할 수 있는 도구임을 입증해야 할 필요가 있다(Mirelman et al., 2019).
마지막으로, 단계적 이원 로지스틱 회귀 분석을 통해 파킨슨병 환자와 건강 대조군을 가장 잘 구별할 수 있는 주요 예측 요인으로써, 빠른 속도의 OMA 방향 회전 과업 시 건측의 스트라이드 길이(Sensitivity: 0.833; specificity: 0.828, AUC: 0.868)와 후방 걷기 시 환측의 스트라이드 길이(Sensitivity: 0.944; specificity: 0.828, AUC: 0.920)로 확인되었다. 이러한 결과는 보행 특성 중에서도 후방 걷기 및 회전 동작과 같은 보다 복잡한 과업 시 수집된 변수들을 기반으로 질병의 특징을 더욱 민감하게 반영할 수 있다는 기존 선행 연구 결과와 일치한다(Mirelman et al., 2019). 또한, 이들 변수는 높은 민감도와 특이도, AUC를 보여주었지만, 파킨슨병의 진단이나 중증도 분류를 위한 도구로 활용하기 위해서는 추가적인 검증과 임상적 기준과의 명확한 비교 연구가 요구되며, 이를 통하여 향후 파킨슨병 환자의 분류 및 질병 진행 평가를 위한 효과적인 지표로 활용 가능할 것이다. 따라서 이러한 객관적이고 민감한 핵심 보행 예측 요인을 통하여 향후 파킨슨병 환자 진단, 질병 심각도 평가, 중재 치료의 효과 평가에 실질적이고 효율적인 임상 도구로써 활용 가능할 것으로 판단된다(Mancini et al., 2025).
이 연구는 여성 파킨슨병 환자의 운동 기능 저하와 질병 중증도를 설명할 수 있는 다차원적 예측 요인을 제시하였다. 특히, 파킨슨병 환자와 건강 대조군을 가장 잘 구별할 수 있는 주요 예측 요인인 빠른 속도의 OMA 방향 회전 과업 시 건측의 스트라이드 길이와 후방 걷기 시 환측의 스트라이드 길이는 향후 맞춤형 중재 프로그램 개발을 위한 중요한 근거로 활용될 수 있을 것이다. 따라서 중재 프로그램 설계 시 균형, 회전 조절, 스트라이드 개선을 목표로 하는 운동 구성 요소를 중심으로 프로그램을 구성할 필요가 있다. 한편, 이 연구의 제한점은 대상자 모집 과정에서 파킨슨병 환자 모집의 제약 및 연구 참여에 대한 건강 대조군의 제한된 수용성 등의 한계로 인하여 대상자 수의 불균형이 존재한다. 또한, 연구 대상이 60-69세 여성으로 한정되어 있어 다른 연령대나 남성 환자에게 결과를 일반화하기 어려우며, 약물 복용 상태에서 평가를 진행하여 실제 운동 장애를 과소 평가했을 가능성이 있다. 이 연구에서 도출한 주요 예측 요인인 보행 특성의 임상적 활용 가능성과 중재 프로그램의 효과를 보다 명확히 검증하기 위해서는 향후 다양한 연령대와 성별을 포함한 대상자 수 확장을 통한 무작위 대조 연구(Randomized con- trolled trial)가 이루어져야 할 것으로 판단된다. 이러한 후속 연구는 파킨슨병 환자의 맞춤형 중재 프로그램이 임상 현장에서 환자의 보조 치료 전략으로 자리잡는 데 과학적, 객관적 기초 자료로서 중요한 역할을 할 것으로 판단된다.
이 연구 결과 경증에서 중증 단계에 있는 60-69세 여성 파킨슨병 환자와 동연령대 건강 대조 그룹 간의 신체활동 수준, 신체 기능, 보행 관련 변수에서 유의한 차이를 확인하였다. 60-69세 여성 파킨슨병 환자는 대조 그룹에 비해 낮은 신체활동 점수와 신체 기능, 보행 속도, 스트라이드 길이, 균형 능력을 보였으며, 보행 시 양하지 지지구간은 증가하고 시간적 협응 능력은 저하된 것으로 나타났다. 특히, 60-69세 여성 파킨슨병 환자의 임상적 심각도(H&Y 단계 및 UPDRS 점수)는 6분 걷기 거리, 평균 보행 속도, 스트라이드 길이, 양하지 지지구간 등 주요 보행 지표들과 유의한 상관관계가 있는 것으로 나타났으며, 이는 질병 진행을 반영하는 유의미한 지표임을 시사한다. 또한, 단계적 로지스틱 회귀 분석을 통해 빠른 속도 환측의 OMA 방향 회전 시 건측의 스트라이드 길이 및 후방 걷기 시 환측 스트라이드 길이가 파킨슨병 환자와 건강 대조군을 효과적으로 분류할 수 있는 주요 예측 요인으로 도출되었다. 이러한 결과는 여성 파킨슨병 환자의 증상 특성과 질병 진행 양상에 따른 차이를 다차원적으로 이해하는 데 기여하며, 향후 맞춤형 중재 프로그램 개발을 위한 과학적, 객관적 근거를 제공할 수 있을 것이며, 후속 연구에서 무작위 대조 그룹 연구를 통하여 맞춤형 중재 프로그램의 효과를 검정하는 연구가 기대된다.
References
1. Adhikari, G. & Pokhrel, R. (2024). Parkinson's disease: causes, symptoms, diagnosis, and treatment. The American Journal of Patient Health Info, 1(01).
Google Scholar
2. American Society of Hand Therapists. (1992). Clinical Assess- ment Recommendations. 2nd ed. Chicago, IL: American Society of Hand Therapists.
3. Batista, P. & Pereira, A. (2016). Biomarkers in neurodegen- erative diseases: cortisol. Journal of Molecular Biomarkers & Diagnosis, 7(2), 1000277.
Google Scholar
4. Behari, M., Srivastava, A. K. & Pandey, R. M. (2005). Quality of life in patients with Parkinson's disease. Parkinsonism & Related Disorders, 11(4), 221-226.
Google Scholar
5. Bertoli, M., Della Croce, U., Cereatti, A. & Mancini, M. (2019). Objective measures to investigate turning impairments and freezing of gait in people with Parkinson's disease. Gait & Posture, 74, 187-193.
Google Scholar
6. Bloem, B. R., de Vries, N. M. & Ebersbach, G. (2015). Non- pharmacological treatments for patients with Parkinson's disease. Movement Disorders, 30(11), 1504-1520.
Google Scholar
7. Bohannon, R. W. (2006). Reference values for the five-repetition sit-to-stand test: a descriptive meta-analysis of data from elders. Perceptual and Motor Skills, 103(1), 215-222.
Google Scholar
8. Canning, C. G., Allen, N. E., Dean, C. M., Goh, L. & Fung, V. S. (2012). Home-based treadmill training for individuals with Parkinson's disease: a randomized controlled pilot trial. Clinical Rehabilitation, 26(9), 817-826.
Google Scholar
9. Carapellotti, A. M., Stevenson, R. & Doumas, M. (2020). The efficacy of dance for improving motor impairments, non-motor symptoms, and quality of life in Parkinson's disease: A systematic review and meta-analysis. PloS One, 15(8), e0236820.
Google Scholar
10. Carpinella, I., Crenna, P., Calabrese, E., Rabuffetti, M., Mazzoleni, P., Nemni, R. & Ferrarin, M. (2007). Locomotor function in the early stage of Parkinson's disease. IEEE Transactions on Neural Systems and Rehabilitation Engineering, 15(4), 543-551.
Google Scholar
11. Craig, C. L., Marshall, A. L., Sjöström, M., Bauman, A. E., Booth, M. L., Ainsworth, B. E., Pratt, M., Ekelund, U., Yngve, A., Sallis, J. F. & Oja, P. (2003). International physical activity questionnaire: 12-country reliability and validity. Medicine & Science in Sports & Exercise, 35(8), 1381-1395.
Google Scholar
12. Davis, R. O. & Katz, D. F. (1992). Standardization and com- parability of CASA instruments. Journal of Andrology, 13(1), 81-86.
Google Scholar
13. Ekker, M. S., Janssen, S., Nonnekes, J., Bloem, B. R. & De Vries, N. M. (2016). Neurorehabilitation for Parkinson's dis- ease: future perspectives for behavioural adaptation. Parkinsonism & Related Disorders, 22, S73-S77.
Google Scholar
14. Enright, P. L. (2003). The six-minute walk test. Respiratory Care, 48(8), 783-785.
Google Scholar
15. Ferrazzoli, D., Ortelli, P., Maestri, R., Bera, R., Gargantini, R., Palamara, G., Zarucchi, M., Giladi, N. & Frazzitta, G. (2017). Focused and sustained attention is modified by a goal-based rehabilitation in parkinsonian patients. Frontiers in Behavioral Neuroscience, 11, 56.
Google Scholar
16. Fisher, B. E., Petzinger, G. M., Nixon, K., Hogg, E., Bremmer, S., Meshul, C. K. & Jakowec, M. W. (2004). Exercise-induced behavioral recovery and neuroplasticity in the 1-methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine-lesioned mouse basal ganglia. Journal of Neuroscience Research, 77(3), 378-390.
Google Scholar
17. Franchignoni, F., Horak, F., Godi, M., Nardone, A. & Giordano, A. (2010). Using psychometric techniques to improve the Balance Evaluation System's Test: the mini-BESTest. Journal of Rehabilitation Medicine: Official Journal of the UEMS European Board of Physical and Rehabilitation Medicine, 42(4), 323.
Google Scholar
18. Goetz, C. G., Poewe, W., Rascol, O., Sampaio, C., Stebbins, G. T., Counsell, C., Giladi, N., Holloway, R. G., Moore, C. G., Wenning, G. K., Yahr, M. D. & Seidl, L. (2004). Movement Disorder Society Task Force report on the Hoehn and Yahr staging scale: status and recommendations the Move- ment Disorder Society Task Force on rating scales for Parkinson's disease. Movement Disorders, 19(9), 1020-1028.
Google Scholar
19. Goetz, C. G., Tilley, B. C., Shaftman, S. R., Stebbins, G. T., Fahn, S., Martinez-Martin, P., Poewe, W., Sampaio, C., Stern, M. B., Dodel, R., Dubois, B., Holloway, R., Jankovic, J., Kulisevsky, J., Lang, A. E., Lees, A., Leurgans, S., LeWitt, P. A., Nyenhuis, D., C. Olanow, W., Rascol, O., Schrag, A., Teresi, J. A., van Hilten, J. J. & LaPelle, N. (2008). Movement Disorder Society-sponsored revision of the Unified Parkinson's Disease Rating Scale (MDS-UPDRS): scale presentation and clini- metric testing re
Google Scholar
20. Gronek, P., Haas, A. N., Czarny, W., Podstawski, R., do Santos Delabary, M., Clark, C. C., Boraczyński, M., Tarnas, M., Wycichowska, P., Pawlaczyk, M. & Gronek, J. (2021). The mechanism of physical activity-induced amelioration of Parkinson's disease: a narrative review. Aging and Disease, 12(1), 192.
Google Scholar
21. Guralnik, J. M., Simonsick, E. M., Ferrucci, L., Glynn, R. J., Berkman, L. F., Blazer, D. G., Scherr, P. A. & Wallace, R. B. (1994). A short physical performance battery assessing lower extremity function: association with self-reported disability and prediction of mortality and nursing home admission. Journal of Gerontology, 49(2), M85-M94.
Google Scholar
22. Hoehn, M. M. & Yahr, M. D. (1967). Parkinsonism: onset, progression, and mortality. Neurology, 50(2), 318-318.
Google Scholar
23. Houston, S. & McGill, A. (2013). A mixed-methods study into ballet for people living with Parkinson's. Arts & Health, 5(2), 103-119.
Google Scholar
24. Hughes, A. J., Daniel, S. E. & Lees, A. J. (2001). Improved accuracy of clinical diagnosis of Lewy body Parkinson's disease. Neurology, 57(8), 1497-1499.
Google Scholar
25. Jankovic, J. & Sherer, T. (2014). The future of research in Parkinson disease. JAMA Neurology, 71(11), 1351-1352.
Google Scholar
26. Jones, G. D., James, D. C., Thacker, M., Jones, E. J. & Green, D. A. (2016). Sit-to-walk and sit-to-stand-and-walk task dynamics are maintained during rising at an elevated seat-height independent of lead-limb in healthy individuals. Gait & Posture, 48, 226-229.
Google Scholar
27. Kang, Y., Na, D. L. & Hahn, S. H. (1997). A validity study on the korean mini-mental state examination (K-MMSE) in dementia patients. Journal of the Korean Neurological Association, 15, 300-307.
Google Scholar
28. Khobkhun, F., Suwannarat, J., Pheungphrarattanatrai, A., Niemrungruang, K., Techataweesub, S., Khacharoen, S., Ajjimaporn, A., Srivanitchapoom, P. & Richards, J. (2021). The effects of a 10-week home-based exercise pro- gramme in individuals with Parkinson's disease during the COVID-19 pandemic: a pilot study. Applied Sciences, 11(10), 4518.
Google Scholar
29. Lee, E. H. (2022). A study on blended-learning methods of dance programs for Parkinson's disease patients. un-published doctor's dissertation. Graduate School of Hanyang University. Seoul.
30. LeWitt, P. A. & Chaudhuri, K. R. (2020). Unmet needs in Parkinson disease: Motor and non-motor. Parkinsonism & Related Disorders, 80, S7-S12.
Google Scholar
31. Li, F., Harmer, P., Fitzgerald, K., Eckstrom, E., Stock, R., Galver, J., Maddalozzo, G. & Batya, S. S. (2012). Tai chi and postural stability in patients with Parkinson's disease. New England Journal of Medicine, 366(6), 511-519.
Google Scholar
32. Lötzke, D., Ostermann, T. & Büssing, A. (2015). Argentine tango in Parkinson disease–a systematic review and meta-analysis. BMC Neurology, 15, 1-18.
Google Scholar
33. Mancini, M., Afshari, M., Almeida, Q., Amundsen-Huffmaster, S., Balfany, K., Camicioli, R., Christiansen, C., Dale, M. L., Dibble, L. E., Earhart, G. M., Ellis, T. D., Griffith, G. J., Hackney, M. E., Hopkins, J., Horak, F. B., Jones, K. E., Ling, L., O'Keefe, J. A., Kwei, K., Olivier, G., Rao, A. K., Sivaramakrishnan, A. & Corcos, D. M. (2025). Digital gait biomarkers in Parkinson's disease: susceptibility/risk, progression, response to exercise, and prognosis. npj Parkinson's Disease, 11(1), 51.
Google Scholar
34. Martignon, C., Ruzzante, F., Giuriato, G., Laginestra, F. G., Pedrinolla, A., Di Vico, I. A., Saggin, P., Stefanelli, D., Tinazzi, M., Schena, F. & Venturelli, M. (2021). The key role of physical activity against the neuromuscular deterioration in patients with Parkinson's disease. Acta Physiologica, 231(4), e13630.
Google Scholar
35. Martinez-Martin, P., Skorvanek, M., Rojo-Abuin, J. M., Gregova, Z., Stebbins, G. T., Goetz, C. G. & QUALPD Study Group. (2018). Validation study of the hoehn and yahr scale included in the MDS-UPDRS. Movement Disorders, 33(4), 651-652.
Google Scholar
36. Meng, L., Shi, Y., Zhao, H., Wang, D., Zhu, X. & Ming, D. (2024). The inertial-based gait normalcy index of dual task cost during turning quantifies gait automaticity improvement in early-stage Parkinson's rehabilitation. Journal of Neuro- Engineering and Rehabilitation, 21(1), 166.
Google Scholar
37. Mirelman, A., Bonato, P., Camicioli, R., Ellis, T. D., Giladi, N., Hamilton, J. L., Hass, C. J., Hausdorff, J. M., Pelosin, E. & Almeida, Q. J. (2019). Gait impairments in Parkinson's disease. The Lancet Neurology, 18(7), 697-708.
Google Scholar
38. Monje, M. H., Sánchez-Ferro, Á., Pineda-Pardo, J. A., Vela-Desojo, L., Alonso-Frech, F. & Obeso, J. A. (2021). Motor onset topography and progression in Parkinson's disease: the upper limb is first. Movement Disorders, 36(4), 905-915.
Google Scholar
39. Morris, M. E., Taylor, N. F., Watts, J. J., Evans, A., Horne, M., Kempster, P., Danoudis, M., McGinley, J., Martin, C. & Menz, H. B. (2017). A home program of strength training, move- ment strategy training and education did not prevent falls in people with Parkinson's disease: a randomised trial. Journal of Physiotherapy, 63(2), 94-100.
Google Scholar
40. National Health Insurance Corporation. National Health In- surance Corporation Statistics (2025). https://nhiss.nhis.or.kr.
41. Nieuwboer, A., Rochester, L., Müncks, L. & Swinnen, S. P. (2009). Motor learning in Parkinson's disease: limitations and potential for rehabilitation. Parkinsonism & Related Disorders, 15, S53-S58.
42. Opara, J. A., Brola, W., Leonardi, M. & Błaszczyk, B. (2012). Quality of life in Parkinsons disease. Journal of Medicine and Life, 5(4), 375.
Google Scholar
43. Palakurthi, B. & Burugupally, S. P. (2019). Postural instability in Parkinson's disease: a review. Brain Sciences, 9(9), 239.
Google Scholar
44. Park, E. H. (2020). Ballet as physical activity for older adult. Korean Journal of Research in Gerontology, 29(1), 25-42.
45. Park, H., Shin, S., Youm, C. & Cheon, S. M. (2024). Deep learning-based detection of affected body parts in Parkinson's disease and freezing of gait using time-series imaging. Scientific Reports, 14(1), 23732.
Google Scholar
46. Park, H., Shin, S., Youm, C., Cheon, S. M., Lee, M. & Noh, B. (2021). Classification of Parkinson's disease with freezing of gait based on 360 turning analysis using 36 kinematic features. Journal of NeuroEngineering and Rehabilitation, 18, 1-18.
Google Scholar
47. Park, J., Koh, S. B., Kwon, K. Y., Kim, S. J., Kim, J. W., Kim, J. S., Park, K. W., Paik, J. S., Sohn, Y. H., Ahn, J. A., Oh, E. S., Youn, J. Y., Lee, J. Y., Lee, P. H., Jang, W. Y., Kim, H. J., Jeon, B. S., Chung, S. J., Cho, J. W., Cheon, S. M., Kang, S. Y., Park, M. Y., Park, S. H., Huh, Y. E., Kang, S. J. & Kim, H. T. (2020). Validation study of the official Korean version of the movement disorder society-unified Parkinson's disease rating scale. Journal of Clinical Neurology (Seoul, Korea), 16(4), 633.
Google Scholar
48. Petzinger, G. M., Walsh, J. P., Akopian, G., Hogg, E., Abernathy, A., Arevalo, P., Turnquist, P., Vučković, M., Fisher, B. E., Togasaki, D. M. & Jakowec, M. W. (2007). Effects of treadmill ex- ercise on dopaminergic transmission in the 1-methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine-lesioned mouse model of basal ganglia injury. Journal of Neuroscience, 27(20), 5291-5300.
Google Scholar
49. Pfeiffer, R. F. (2016). Non-motor symptoms in Parkinson's dis- ease. Parkinsonism & Related Disorders, 22, S119-S122.
Google Scholar
50. Plotnik, M., Giladi, N. & Hausdorff, J. M. (2009). Bilateral coord- ination of gait and Parkinson's disease: the effects of dual tasking. Journal of Neurology, Neurosurgery & Psychiatry, 80(3), 347-350.
Google Scholar
51. Plotnik, M., Giladi, N., Dagan, Y. & Hausdorff, J. M. (2011). Postural instability and fall risk in Parkinson's disease: impaired dual tasking, pacing, and bilateral coordination of gait during the "ON" medication state. Experimental Brain Research, 210(3-4), 529-538.
Google Scholar
52. Podlewska, A. M., Batzu, L., Soukup, T., Sevdalis, N., Bakolis, I., Derbyshire-Fox, F., Hartley, A., Healey, A., Woods, A., Crane, N., Pariante, C. & Ray Chaudhuri, K. (2024). The PD-Ballet study: study protocol for a randomised controlled single-blind hybrid type 2 clinical trial evaluating the effects of ballet dancing on motor and non-motor symptoms in Parkinson's disease. BMC Complementary Medicine and Therapies, 24(1), 41.
Google Scholar
53. Politis, M., Wu, K., Molloy, S., G. Bain, P., Chaudhuri, K. R. & Piccini, P. (2010). Parkinson's disease symptoms: the patient's perspective. Movement Disorders, 25(11), 1646-1651.
Google Scholar
54. Rocchi, L., Chiari, L. & Horak, F. (2002). Effects of deep brain stimulation and levodopa on postural sway in Parkinson's disease. Journal of Neurology, Neurosurgery & Psychiatry, 73(3), 267-274.
Google Scholar
55. Roh, Y. J. (2024). Analysis of english national ballet's dance for parkinson's. The Korea Dance Education Society, 35(1), 59-77.
56. Schenkman, M., Moore, C. G., Kohrt, W. M., Hall, D. A., Delitto, A., Comella, C. L., Josbeno, D. A., Christiansen, C. L., Berman, B. D., Kluger, B. M., Melanson, E. L., Jain, S., Robichaud, J. A., Poon, C. & Corcos, D. M. (2018). Effect of high-intensity treadmill exercise on motor symptoms in patients with de novo Parkinson disease: a phase 2 randomized clinical trial. JAMA Neurology, 75(2), 219-226.
Google Scholar
57. Shin, E. S. (2020). Development of adult ballet program integrating classical ballet repertory, musical and liberal art element and its effect analysis. Official Journal of Korean Society of Dance Science, 37(4), 55-65.
58. Silva-Batista, C., de Lima-Pardini, A. C., Nucci, M. P., Coelho, D. B., Batista, A., Piemonte, M. E. P., Barbosa, E. R., Teixeira, L. A., Corcos, D. M., Amaro, E., Horak, F. B. & Ugrinowitsch, C. (2020). A randomized, controlled trial of exercise for Parkinsonian individuals with freezing of gait. Movement Disorders, 35(9), 1607-1617.
Google Scholar
59. van der Heeden, J. F., Marinus, J., Martinez-Martin, P., Rodriguez-Blazquez, C., Geraedts, V. J. & van Hilten, J. J. (2016). Postural instability and gait are associated with severity and prognosis of Parkinson disease. Neurology, 86(24), 2243-2250.
Google Scholar
60. Van der Kolk, N. M. & King, L. A. (2013). Effects of exercise on mobility in people with Parkinson's disease. Movement Disorders, 28(11), 1587-1596.
Google Scholar
61. Verghese, J., Lipton, R. B., Hall, C. B., Kuslansky, G., Katz, M. J. & Buschke, H. (2002). Abnormality of gait as a predictor of non-Alzheimer's dementia. New England Journal of Medicine, 347(22), 1761-1768.
Google Scholar
62. Willemssen, R., Müller, T., Schwarz, M., Hohnsbein, J. & Falkenstein, M. (2008). Error processing in patients with Parkinson's disease: the influence of medication state. Journal of Meural Transmission, 115(3), 461-468.
63. Wu, T., Hallett, M. & Chan, P. (2015). Motor automaticity in Parkinson's disease. Neurobiology of Disease, 82, 226-234.
Google Scholar
64. Xu, J., Gong, D. D., Man, C. F. & Fan, Y. (2014). Parkinson's disease and risk of mortality: meta-analysis and systematic review. Acta Neurologica Scandinavica, 129(2), 71-79.
Google Scholar
65. Youm, C., Kim, Y., Noh, B., Lee, M., Kim, J. & Cheon, S. M. (2020). Impact of trunk resistance and stretching exercise on fall-related factors in patients with parkinson's disease: A randomized controlled pilot study. Sensors, 20(15), 4106.
Google Scholar