Open Access, Peer-reviewed
eISSN 2093-9752

Open Access, Peer-reviewed
eISSN 2093-9752
Shin-Young Park
Do-Kyung Ko
Hyeong Do Jeong
Hanall Lee
Hyungwoo Lee
Chanki Kim
Seungho An
Jiyoung Kim
Bosung Moon
Jee-Soo Son
Dohyeon Lee
Eui-Young Lee
Ju Hak Lee
Seungbin Im
Yuan Tan
Kyoungkyu Jeon
Nyeonju Kang
http://dx.doi.org/10.5103/KJSB.2022.32.3.94 Epub 2022 October 06
Abstract
Objective: The purpose of this study was to investigate the effect of acute transcranial direct current stimulation (tDCS) on the isokinetic muscular endurance of the lower extremity for young adults.
Method: Thirteen young adults performed isokinetic fatigue tasks for two experimental conditions including real tDCS and sham stimulation protocols. Before and after the task, the tensiomyography was used for evaluating muscle contraction characteristics of vastus medialis and semitendinosus. Paired t-test was performed to compare the fatigue index, changes in maximum radial displacement (ΔDm), delay time (ΔTc), and velocity of contraction (ΔVc) between tDCS conditions.
Results: We found no significant differences in the fatigue index between real and sham conditions. In addition, the analyses identified no significant different values of ΔDm, ΔTc, and ΔVc in the vastus medialis and semitendinosus between real and sham conditions.
Conclusion: These findings suggest that the tDCS protocols may have no acute effect on lower limb muscle endurance for young adults. Future studies should consider the long-term effects of repetitive tDCS sessions, various stimulation positions, exercise tasks, and participant characteristics to more clearly understand the effect of tDCS on muscle endurance of lower extremities.
Keywords
Transcranial direct current stimulation Muscle fatigue Muscle endurance Lower limb Isokinetic dynamometry Tensiomyography
근피로는 운동 중 경험하는 비특이적 증상이며, 근육 내 에너지 고갈, 대사산물 증가 등의 말초적 요인으로 인해 발생하기도 하지만, 대뇌 운동 영역에서 발생되는 신경 신호의 감소와 같은 중추적 요인으로도 발생될 수 있다(Gandevia, 2001; Wan, Qin, Wang, Sun & Liu, 2017). 실제 반복적인 최대 수의적 수축으로 인해 근피로가 발생되었을 때, 대뇌 운동피질(primary motor cortex, M1)의 활성도가 감소되는 경향이 나타났다(Liu, Zhang, Yao, Sahgal & Yue, 2005). 스포츠 상황에서 근피로는 근력 및 근지구력 감소와 같은 운동 수행 능력 저하로 이어질 수 있기 때문에(Enoka & Duchateau, 2016), 근피로를 지연시킴으로써 운동 수행 능력을 유지 혹은 향상시키기 위한 다양한 방법들이 연구되어 왔다. 최근에는 뇌에 대한 신경학적 변화를 유도함으로써 운동 능력을 향상시키는 방법에 대한 연구가 이루어지고 있으며, 그 중 대표적인 방법이 경두개 직류전기자극(transcranial direct current stimulation, tDCS)이다(Machado et al., 2019).
tDCS는 뇌의 피질 흥분성 변화를 유도하기 위해 1~2 mA의 약한 전류를 머리 표면에 전달하는 비침습적 뇌 자극술(non-invasive brain stimulation, NIBS)이며(Yavari, Jamil, Samani, Vidor & Nitsche, 2018), 뇌졸중과 같은 다양한 신경학적 질환자 등 다양한 집단의 운동기능 개선을 위한 목적으로 활용되고 있다(Bornheim et al., 2022; Pol, Salehinejad, Baharlouei & Nitsche, 2021; Zhang et al., 2021). 양극 tDCS는 신경 흥분성을 증가시키고, 음극 tDCS는 신경 흥분성을 감소시키는 작용을 하는 것으로 알려져 있다(Samani, Agboada, Jamil, Kuo & Nitsche, 2019). 이 중 양극 tDCS는 안정 시 막전위의 역치를 감소시킴으로써 운동피질의 신경 흥분성 증가를 유도하는 것으로 예상되며(Nitsche et al., 2003), 증가된 신경 흥분성은 신경세포의 발화 빈도(firing frequency)와 근육으로의 신경 자극을 증가시키는 것으로 예측된다. 이는 운동단위의 동원을 촉진해 효율적인 근수축을 이끌어내고 결과적으로 근력과 근지구력을 증가시킬 수 있을 것으로 사료된다(Dutta, Krishnan, Kantak, Ranganathan & Nitsche, 2015). 또한, tDCS는 운동피질의 시냅스 가소성(synaptic plasticity)을 촉진시킴으로써 근지구력의 증가를 유도할 수도 있다는 보고가 있으며(Lu, Hanson, Wen, Guo & Tian, 2021), M1에 대한 양극 tDCS의 자극은 통증의 역치점을 증가시킨다는 연구 결과가 존재한다(Vaseghi, Zoghi & Jaberzadeh, 2014). 종합해 보면, tDCS를 통해 M1 영역을 자극하는 것은 근지구력과 같은 운동 기능 향상에 긍정적인 영향을 미칠 것으로 사료된다(Colzato, Nitsche & Kibele, 2017; de Moura et al., 2019; Machado et al., 2019; Wang et al., 2022).
실제로, tDCS의 적용이 대퇴사두근의 탈진까지 걸리는 시간(time to exhaustion, TTE)을 유의하게 증가시킴으로써 tDCS가 근피로를 지연시킬 수 있다고 보고하였으며(Angius et al., 2018), 젊은 성인 남녀를 대상으로 tDCS 실시 전 · 후 팔꿈치굴곡근의 등속성 근지구력을 측정한 결과, tDCS가 적용되었을 때 근지구력이 유의하게 향상되었다(Cogiamanian, Marceglia, Ardolino, Barbieri & Priori, 2007; Williams, Hoffman & Clark, 2013). 하지만, 젊은 성인 남성을 대상으로 한 tDCS의 사용이 팔꿈치굴곡근의 등속성 근지구력 증가에 유의한 효과를 나타내지 못했다는 보고도 존재한다(Kan, Dundas & Nosaka, 2013; Muthalib, Kan, Nosaka & Perrey, 2013). 점진적으로 부하를 증가시키는 사이클링 운동의 경우 tDCS가 부여되었을 때, 운동 수행 시간이 유의하게 증가되었다는 연구가 있다(Angius et al., 2018; Barwood et al., 2016; Lattari et al., 2018; Okano et al., 2015; Vitor-Costa et al., 2015). 이처럼 근지구력에 대한 tDCS의 영향이 일관되지 않으며, 하지 근지구력이 운동 수행력 중 중요한 요인임에도 불구하고 tDCS가 하지 근지구력에 미치는 영향에 대해 분석한 연구가 부족한 실정이다.
등속성 근장력계(isokinetic dynamometry)와 근장력측정기(tensio- myography, TMG)는 근육의 수축 특성과 관련된 연구에서 자주 사용된다. 등속성 근장력계는 근력, 힘, 일과 같은 수의적 근육 특성을 평가하는 데 사용되는 방법이며(Pincivero, Lephart & Karunakara, 1997; Park, Ryu & Kim, 2014; Han & Kim, 2003), TMG는 근육 강직, 근육의 불수의 수축 및 기계적인 특성을 평가하는 방법이다(Macgregor, Hunter, Orizio, Fairweather & Ditroilo, 2018; Martín-Rodríguez, Loturco, Hunter, Rodríguez-Ruiz & Munguia-Izquierdo, 2017). 선행연구에 따르면 트라이애슬론 운동선수를 대상으로 경기 전 · 후 근육의 최대 수축 변위와 수축 시간, 수축 속도를 평가함으로써 근지구력을 분석하는 데 TMG를 이용하였다(García-Manso et al., 2011; Martín-San Agustín et al., 2020). 또한, TMG를 통해 비침습적으로 근피로도의 변화를 평가할 수 있다고 언급하였다(de Paula Simola et al., 2016; Martín-San Agustín et al., 2020).
본 연구에서는 tDCS의 적용이 근피로도를 개선할 수 있을 것이라 예측하였다. 연구의 목적을 위해 등속성 근장력계와 TMG를 사용하여 근피로도 및 근육의 수축 특성을 분석하고자 하였다. 따라서, 본 연구의 목적은 일회성 tDCS의 적용이 젊은 성인의 하지 근피로도 변화에 미치는 영향에 대해 규명하는 것이다.
1. 연구 대상자 특성
본 연구에는 건강한 20대 성인 11명이 실험에 참여하였다. 연구 대상자 모집 시 하지 및 체간 근골격계와 신경계에 이상이 없는 대상으로 모집이 되었으며, 대상자 특성은 (Table 1)과 같다. 평가할 하지를 결정하기 위해 "어떤 하지로 공을 차는가?"라는 질문을 통해 우성 하지를 결정하였다(Paillard & Noé, 2020). 모든 대상자는 실험을 진행하기 앞서, 실험 과정에 관하여 자세한 설명을 전달 및 숙지를 받았다.
|
Characteristics |
Participants |
|
Sample
Size (N) |
11 (2
Females and 9 Males) |
|
Age
(years) |
26.00±2.73 |
|
Footedness |
11
right-footed |
|
Weight
(kg) |
73.65±11.11 kg |
|
Height
(cm) |
173.20±6.60 cm |
2. 실험 절차
연구 대상자는 1주일의 간격을 두고 총 2회 실험실을 방문하였다(Gualano et al., 2011; Thongsawang, Krataithong, ChorCharoenying, Norchai & Nokkaew, 2021). 본 연구는 tDCS가 하지 근피로 및 근육의 수축 특성에 미치는 영향을 분석하기 위한 이중맹검, 교차설계연구(double blind, crossover design)로, 연구자는 대상자를 무작위로 real condition 그룹과 sham condition 그룹으로 나누었다. 모든 대상자는 실험실 방문 직후 근장력계(TMG-100 System electrostimulator, Slovenia)를 이용하여 우성 하지의 내측광근(vastus medialis oblique, VMO)과 반건양근(semitendinosus, ST)에 대한 근육의 수축 특성을 측정하였다. 그 후 tDCS 중재를 받는 20분 동안 3.5 km/h의 속도로 트레드밀을 걸으며 준비운동을 실시하였다. 준비운동 시 real condition 그룹은 2 mA로 20분간 전기 자극을 보냈고, sham condition 그룹은 2 mA로 30초간 자극을 보낸 후 전기 자극을 차단하였다. tDCS 중재를 포함한 준비운동이 끝난 대상자는 등속성 근관절 기능 검사 장비(Humac Norm Testing & Rehabilitation, CSMi Medical & Solution, USA)를 활용하여 무릎 관절의 굴곡근과 신전근에 대한 등속성 근피로 검사를 실시한 후 TMG를 이용하여 사전과 동일한 근육의 수축 특성을 측정하였다. 1주일 후 real condition 그룹과 sham condition 그룹을 교차하여 동일한 프로토콜로 실험을 진행하였다(Figure 1).
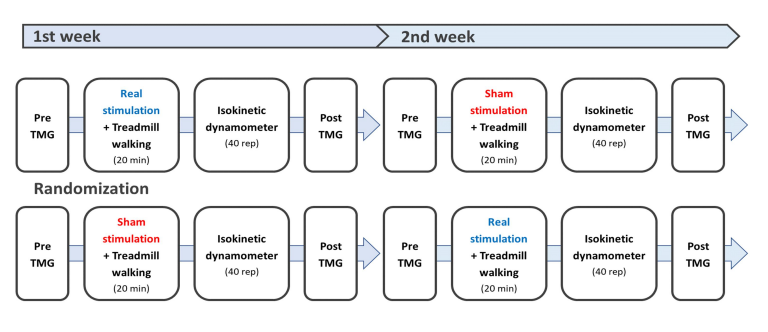
1) 경두개 직류전기자극 중재
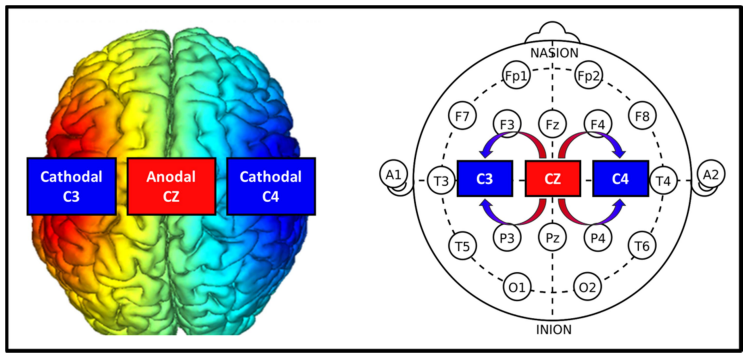
tDCS 적용을 위해 Halo Sport (Halo Neuroscience, USA)를 머리에 착용하였고, real condition 시 대상자의 좌측 운동 영역(left M1 = C3)과 우측 운동 영역(right M1 = C4)에 음극 전류를, 운동 영역(M1 = Cz) 중앙에 양극 전류를 비금속 전극(primer 6×4 = 24 cm2)을 통해 제공하였다(Figure 2). 전류 강도는 음극 전류는 좌 · 우측에 각각 0.96 mA, 양극 전류는 1.98 mA로 설정하였으며, sham condition의 경우, 처음 30초 동안 real condition과 같은 조건의 tDCS를 적용한 뒤 연구 대상자가 알지 못하도록 애플리케이션을 조작해 자극을 중단하였다. 모든 대상자는 tDCS 자극을 적용받는 20분 동안 준비운동으로 트레드밀(FDM, Zebris Medical GmbH, Germany)을 활용해 3.5 km/h의 속도로 걷게 하였다.
2) 등속성 근피로 검사
tDCS 중재 후, 무릎 관절의 굴곡근 및 신전근의 근지구력 측정을 위해 등속성 근관절 기능 검사 장비를 활용하여 근피로도를 평가하였다. 측정 자세는 등을 기대어 편안하게 앉게 한 후, 검사 장비의 다이너모미터(dynamometer)에 무릎 관절 굴곡 및 신전 검사용 어댑터(ankle adapter)를 연결하여, 무릎 관절을 90° 굴곡시킨 상태에서 운동축과 다이너모미터의 운동축을 일치시켰다. 측정 시 다른 신체 관절의 힘이 전달되지 않도록 상체와 대퇴부를 벨트로 고정하였고, 각 대상자마다 스스로 통제할 수 있는 최대 굴곡 및 신전 관절 가동 범위를 설정하였다. 근피로 측정은 120°/s 각속도에서 연속적인 무릎 굴곡근 및 신전근의 구심성 수축 40회 반복으로 설정하였다. 측정 전 모든 연구 대상자들은 예비 운동을 실시하여 측정 동작에 적응하였으며(Workman, Kamholz & Rudroff, 2019), 측정 중 일정한 근지구력을 발휘할 수 있도록 구두로 격려하였다.
3) 근육의 수축 특성 평가
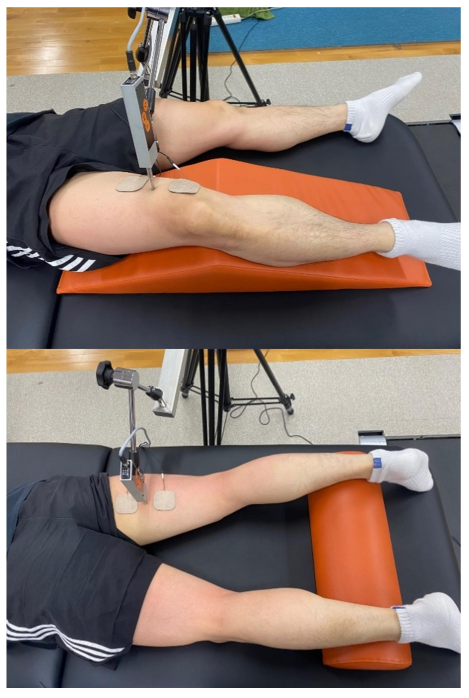
하지의 굴곡근 및 신전근의 수축 특성은 TMG를 활용하여 평가하였다. 측정 부위는 신전 시 실질적인 기여도가 큰 VMO와 굴곡 시 다른 근육에 비해 더 큰 부하 및 경직이 발생되는 ST를 측정하였으며(de Souza, Cabral, de Oliveira & Vieira, 2018; Mendes et al., 2020), VMO와 ST가 이완된 정적인 상태에서 측정하였다. TMG 센서의 위치 변동성을 최소화하기 위해 VMO 측정 시 앙와위 자세에서 무릎 관절의 후면부에 삼각형 웨지 폼 쿠션(wedge foam cushion)을 배치하여 무릎 관절 굴곡 각도 150°를 유지하였고, ST 측정 시 발목 관절에 패드를 위치시켜 5° 무릎 관절 굴곡 상태를 유지하였다. 근육 수축 변위의 최대 값인 15 mm를 고려하여 VMO와 ST 근복 중앙 부위를 펜으로 표시한 후 디지털 변위 센서(GK 40, Panoptik doo, Ljubljana, Slovenia)를 표시된 부위에 수직으로 배치하였다(Perotto, 2011). 전극 패드는 센서에 대칭이 되도록 하여 5 cm 간격으로 근위부에 양극 패드, 원위부에 음극 패드를 배치하였다. 단일 전기 자극은 초기 20 mA에서 시작해 20 mA 간격으로 증가시켜 최대 변위가 나타날 때까지 점진적 측정하였다. 이때 근육의 피로 반응을 최소화하기 위해 각 측정 시점 간 15초간 휴식시간을 부여하였다. 측정 위치는 아래 사진과 같다(Figure 3).
3. 자료 분석
1) 무릎 관절의 등속성 수축 시 굴곡근 및 신전근 피로 지수
무릎 관절의 등속성 근피로 검사를 위해 120°/s 각속도에서 굴곡 및 신전을 40회 반복하여 실시하였다. 모든 횟수에서 측정된 굴곡근 및 신전근의 최대 토크 값(peak torque, Nm)을 측정하였고, 모든 토크 값은 연구 대상자의 체중을 고려하여 근력 값에서 체중을 나눈 체중에 대한 최대 토크 값(% peak torque/body weight)을 분석에 사용하였다. 본 연구에서 피로 지수(fatigue index, FI)는 등속성 근피로 검사 동안 우성 하지의 무릎 관절의 굴곡근 및 신전근의 초기와 후기에서 발생된 토크 값의 감소율로 정의된다. 따라서 피로 지수가 높다는 것은 근피로가 크게 발생하였다는 것을 의미한다. 피로 지수는 아래와 같은 공식을 통해 계산되었다. 이때 측정 초기의 적응 효과를 배제하기 위해 처음 2번의 반복은 제외하였기 때문에 처음 5회의 반복 평균은 3~7회 반복의 평균값을 의미한다(Workman et al., 2019).
피로 지수= 처음 5회 반복의 평균값 -마지막 5회 반복의 평균값/ 처음 5회 반복의 평균값 X100
2) 무릎 관절의 굴곡근 및 신전근의 수축 특성 분석
근육의 수축 특성을 분석하기 위해 TMG를 사용하였으며, 1 ms의 전기 자극(0~100 mA)으로 발생되는 근육의 최대 수축 변위를 기록하는 maximum radial displacement (Dm)과 최대 수축 변위의 10~90%까지 수축하는데 걸리는 시간인 contraction time (Tc)를 활용하였다(Martín-Rodríguez et al., 2017). Dm은 근육 강직도를 평가하기 위한 변인으로, 피로에 의해 근육 강직도가 증가함에 따라 최대 수축 변위가 감소하는 것으로 나타났다(Macgregor, Ditroilo, Smith, Fairweather, & Hunter, 2016). 또한 Tc는 수축 시간으로, 근피로에 의해 수축력이 감소함에 따라 수축 시간이 증가하는 형태로 보고되었다(Eo & Hwang, 2017). 여기서 Tc는 Dm 값에 의해 영향을 받을 수 있으므로 이를 보완하기 위해 Tc와 Dm, delay time (Td)을 사용하여 velocity of contraction (Vc)를 산출하였다. 여기서 Td는 전기 자극 시작부터 최대 수축 변위의 10%에 도달하는 지연 시간을, Vc는 근육의 수축 속도를 의미하며 Vc를 산출하기 위한 계산식은 아래와 같다(Loturco et al., 2016). 낮은 수축 속도는 근피로에 의한 수축력 감소와 관련이 있다(Lohr, Braumann, Reer, Schroeder & Schmidt, 2018; Raeder et al., 2016). 최종적으로 근육의 수축 특성에 대한 모든 변인은 하지 근지구력 과제 전 · 후의 변화 값을 사용하였다(post-pre; Δ-value).
4. 통계 처리
본 연구의 통계 처리는 SPSS 26.0 (IBM, USA)을 이용하여 각 변인의 평균과 표준오차(mean ± standard error)를 산출하였다. tDCS (real condition vs. sham condition) 중재에 따른 대상자의 무릎 관절 굴곡근 및 신전근의 피로 지수와 근육의 수축 특성 변화를 비교하기 위해, 대응 표본 t-검정(paired t-test)을 실시하였다. 모든 통계 결과에 대한 유의수준은 p < .05로 설정하였다.
1. 무릎 관절의 등속성 굴곡근 및 신전근의 피로 지수 분석
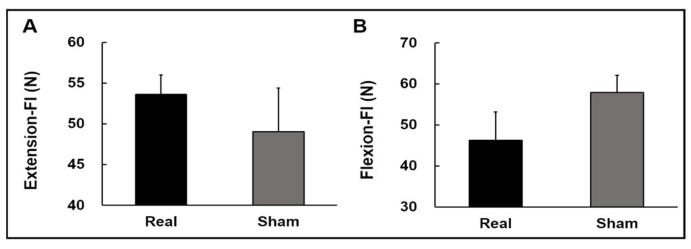
Real condition과 Sham condition의 무릎 신전 피로 지수에 대한 분석 결과, 유의한 차이가 나타나지 않았다(t11 = 1.134; p = 0.281; Figure 4A). 또한 무릎 굴곡 피로 지수에서도 유의한 차이가 나타나지 않았다(t11 = -1.788; p = 0.101; Figure 4B). 이는 tDCS를 통한 전기적 자극을 제공하는 것이 무릎의 신전 및 굴곡의 피로도 개선에 영향을 주지 않았음을 의미한다.
2. 근육의 수축 특성 분석
뇌 전기 자극 조건에 따른 하지 근지구력 과제 전 · 후 시점에 대한 차이값(post-pre; Δ-value)에 대한 분석 결과, 첫째, VMO의 ΔDm에서 유의한 차이가 나타나지 않았다(t11 = -1.619; p = 0.134; Figure 5A). 둘째, VMO의 ΔTc에서도 유의한 차이가 나지 않았다(t11 = -0.965; p = 0.355; Figure 5B). 셋째, VMO의 ΔVc 또한 유의한 차이가 나지 않았다(t11 = -1.221; p = 0.248; Figure 5C). 이러한 결과는 tDCS의 자극이 근지구력 운동 과제 전 · 후 VMO의 최대이동변위, 수축 시간, 근육 수축 속도의 유의한 변화를 이끌어내지 못 했음을 의미한다.
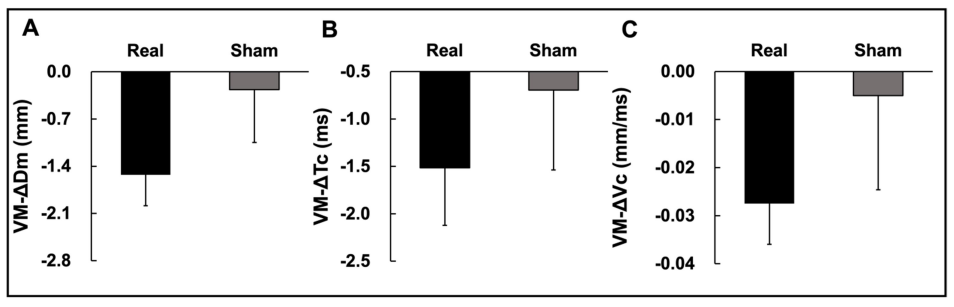
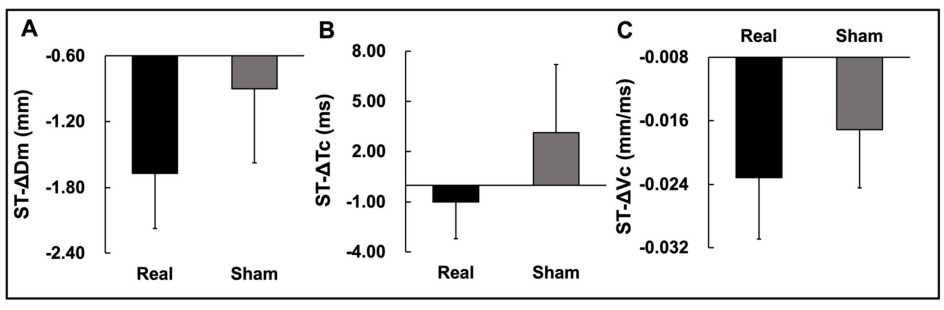
추가적으로, 자극 조건 별 ST의 ΔDm의 값들을 분석한 결과 유의한 차이가 나타나지 않았다(t11 = -1.010; p = 0.334; Figure 6A). ST의 ΔTc 또한 유의한 차이가 나타나지 않았다(t11 = -1.440; p = 0.178; Figure 6B). 마지막으로, ST의 ΔVc에서도 유의한 차이가 나타나지 않았다(t11 = -0.535; p = 0.603; Figure 6C). 이러한 결과는 tDCS 의 자극이 ST의 Dm, Tc, 및 Vc 변화량에 영향을 주지 않았음을 의미한다.
본 연구는 젊은 성인을 대상으로 한 등속성 근지구력 과제에서 일회성 tDCS 적용이 하지 근지구력에 미치는 영향을 조사하였다. 연구 결과 tDCS의 적용에 따라 하지의 등속성 근지구력 운동 과제 시 무릎 굴곡근 및 신전근의 피로 지수에서 유의한 차이가 나타나지 않았다. 또한 과제 전 · 후 시점에 대한 모든 TMG 변인의 변화 값에서 tDCS 자극 조건 간의 유의한 차이가 나타나지 않았다. 이는 일회성 tDCS 적용이 등속성 근지구력 과제 이후 하지 근지구력에 유의미한 영향을 미치지 못하였음을 나타낸다.
치료적 개입의 임상적 유용성을 평가하는 데 있어 중요한 요소는 관찰된 효과의 지속성이다. tDCS를 통한 전기 자극은 목표로 하는 부위의 시냅스 연결을 강화할 수 있으며(Stagg & Nitsche, 2011), 장기간 강화를 통해 시냅스 가소성 변화를 유도할 수 있다. 이러한 tDCS 효과의 지속 시간은 적용 세션의 수의 따라 상이하다(Nitsche et al., 2003; Rostami et al., 2020). 일반적으로 일회성 tDCS의 효과는 지속 시간이 짧고 기능적 변화가 꾸준히 재현되지 않은 반면, 장기간의 tDCS 프로토콜은 젊고 건강한 피험자에서 더 안정적이고 지속적인 효과를 유도하는 것으로 나타났다(Alonzo, Brassil, Taylor, Martin & Loo, 2012; Dumel et al., 2018; Gálvez, Alonzo, Martin & Loo, 2013). 선행연구에서는 매일 5일 동안의 M1 영역에 가해진 tDCS 중재에 따라 젊고 건강한 성인들에게서 피질 흥분성 변화의 누적이 보고되었다(Gálvez et al., 2013). 비록 본 연구에서는 tDCS의 일회성 적용에 따른 변화가 나타나지 않았지만, 장기간의 반복적인 tDCS의 적용은 근지구력의 개선에 영향을 미칠 수 있을 것으로 사료된다(Brunoni et al., 2012; Dumel et al., 2018; Reis et al., 2009).
운동 수행력에 관여하는 뇌의 영역은 복잡한 상호작용을 통해 영향을 미치기 때문에 특정 운동 능력의 향상을 위해 사용될 수 있는 최적의 tDCS 프로토콜은 다양할 수 있다. tDCS가 근피로를 개선하는 데 영향을 미치는 명확한 기전은 아직 밝혀지지 않았으며, 특히 선행연구들 사이에서도 최적의 전극 위치에 대한 상당한 의견 차이가 존재한다(Machado et al., 2019). M1은 운동 신경의 활성화를 유지시키며 중추 피로를 보상함으로써 근지구력을 향상시키는 역할을 하기 때문에, 운동기능 향상을 위한 전형적인 자극 위치로 사용되었다(Chinzara, Buckingham & Harris, 2021; Papale & Hooks, 2018). 또한 M1의 활성화를 통해 통증 인식을 조절할 수 있을 것으로 사료되는데, 선행연구에 따르면 M1의 양극 tDCS는 건강한 성인 및 만성 통증 환자에서도 감각 및 통증 역치를 증가시키는 것으로 보고되었다(Vaseghi et al., 2014). 운동으로 인한 통증은 운동 수행에 있어 중요한 역할을 하며, 운동 중 통증을 참거나 극복할 능력이 더 나은 결과로 나타날 수 있다(Mauger, 2013).
이 외에도 전전두엽피질(prefrontal cortax, PFC)은 운동 지속 능력과 관련한 인지적 관점에서 또 다른 대안이 될 수 있다. PFC는 수행 중인 운동과 관련된 내부 및 외부 정보의 처리에 중요한 역할을 하며, 운동 수행에 영향을 미치는 잠재적 동기, 노력에 대한 인식, 과제 수행에 대한 의사결정에 관여할 수 있다(Pageaux, 2014; Robertson & Marino, 2016). 선행연구는 정신적 피로와 같이 PFC 능력을 감소시키기 위한 개입이 지구력을 감소시킬 수 있음을 보고하였다(Van Cutsem et al., 2017). 따라서 PFC에 적용된 tDCS는 근피로에 따른 신체 변화에도 불구하고 운동 수행을 지속하는 능력을 강화할 수 있다. 사용 가능한 또 다른 영역으로는 섬피질(insular cortex, IC)이 존재한다. 우측 IC는 교감신경(sympathetic nerve) 조절에 관여하는 반면, 좌측 IC는 부교감신경(parasympathetic nerve) 조절에 관여한다(Napadow et al., 2008). IC는 뇌의 비교적 깊은 영역에 위치해 있기 때문에 IC와 연결된 측두엽(temporal cortex, TC) 자극을 통해 IC의 활성화를 유도한다(Okano et al., 2015). 이러한 기전에 따라 좌측 TC를 자극하여 이루어지는 IC의 활성화는 부교감신경의 조절력을 높여 피로를 지연시킬 수 있다(Okano et al., 2015). 본 연구에서는 M1 영역의 자극만 적용 가능한 Halo sport 장비를 사용하였으므로, 향후 연구에서는 다양한 부위의 자극을 통해 나타날 수도 있는 근지구력 변화를 살펴볼 필요가 있다.
또한 본 연구에서는 tDCS 중재를 통해 하지 근지구력에 미치는 영향을 조사하기 위해 단일 관절 운동(single-joint exercises)인 무릎 관절의 등속성 수축 과제를 사용하였다. 단일 관절 운동과 하지 전체를 사용하는 다중 관절 운동(multiplejoint exercises) 간 기능적인 요구가 서로 다르기 때문에, tDCS의 효과 또한 차이가 나타날 수 있다(Alix-Fages et al., 2019; Angius, Hopker, & Mauger, 2017). 단일 관절 운동은 상대적으로 외적인 요소가 제거되어 보다 통제된 실험 환경을 효과적으로 제공해 주지만, 다중 관절 운동은 실제 스포츠 상황을 더 잘 반영하기 때문에 현장에 적용함에 있어서 타당성을 제공해 준다. 최근 수행된 tDCS 메타분석 연구에서 다중 관절 운동(사이클링) 과제를 사용한 연구가(ES = 0.41) 단일 관절 운동 과제를 사용한 연구(ES = 0.15)에 비해 더 큰 효과 크기를 보고하였음을 볼 때, 추후 tDCS의 하지의 근지구력에 대한 효과를 평가함에 있어서 다양한 하지 운동 과제 선정에 대해 고려해야 할 것으로 생각된다(Alix-Fages et al., 2019).
추가적으로, 본 연구의 대상자는 모두 건강한 20대 성인이며 근지구력이 향상됨에 있어 천장 효과로 인해 tDCS의 효과가 미비할 수 있다(Workman et al., 2019). 실제로 하지의 등속성 근지구력 과제에서 연령과 관련된 피로도를 조사한 선행연구에서는 노인에게서 더 큰 피로가 나타났다(Senefeld, Yoon & Hunter, 2017). 근피로의 연령 관련 기전은 아직 명확히 밝혀지지 않았지만, 등척성 수축에서는 노인의 피로 저항성이 우수한 반면 본 연구에서 수행한 과제와 같이 상대적으로 높은 각속도에서는 젊은 성인의 피로 저항성이 우수한 것으로 보고되었다(Callahan & Kent-Braun, 2010). 다른 선행연구는 tDCS를 통한 피로의 개선이 다발성경화증(multiple sclerosis)과 같은 대상자들에게서 신경 흥분성을 증가시킬 가능성이 있으므로 건강한 대상자에 비해 피로 개선의 효과가 더 높을 수 있다고 언급하였다(Sánchez-Kuhn, Pérez-Fernández, Cánovas, Flores & Sánchez-Santed, 2017; Workman et al., 2019). 따라서, 등속성 근지구력 과제에서 젊은 성인 집단의 우수한 피로 저항성으로 인해 tDCS 적용의 천장 효과가 나타났을 수 있다. 또한 성별과 tDCS 강도 차이에 따른 피로 지수를 측정한 선행연구에서, 여성은 sham condition과 real condition (4 mA) 간 유의한 차이를 보였으나 남성은 tDCS 강도에 따른 피로 지수의 차이가 없었다(Workman, Fietsam & Rudroff, 2020). tDCS의 반응이 성별에 따라 다르게 나타난 원인으로는 남성과 여성 간 골피질(cortical bone) 및 해면골(cancellous bone) 밀도와 같은 두개골의 구조 및 구성과 호르몬 수치의 차이로 인한 것으로 보고되었다(Chaieb, Antal & Paulus, 2008; Krause & Cohen Kadosh, 2014; Russell, Goodman, Wang, Groshong & Lyeth, 2014). 본 연구의 참여한 대상자들의 성별은 남성의 비율이 상대적으로 높았으며 이러한 성비는 tDCS 적용에 대한 근지구력의 향상을 제한할 수도 있을 것으로 사료된다.
본 연구에서는 젊은 성인을 대상으로 한 등속성 근지구력 과제에서 일회성 tDCS의 적용이 하지의 근지구력에 미치는 영향을 조사하였다. 연구 결과, 일회성 tDCS의 적용이 근육의 피로 지수와 수축 특성의 개선에 유의한 변화를 이끌어 내지 못하였으며, 이는 일회성 tDCS가 젊은 성인의 하지 근지구력에 영향을 미치지 않았음을 의미한다. 향후에는 tDCS의 장기간의 반복 적용을 통한 하지 근지구력에 대한 효과와 다양한 자극 위치, 운동 과제, 대상자의 특성을 고려한 추가적인 후속 연구가 필요할 것으로 판단된다.
References
1. Alix-Fages, C., Romero-Arenas, S., Castro-Alonso, M., Colomer-Poveda, D., Río-Rodriguez, D., Jerez-Martínez, A. ... & Márquez, G. (2019). Short-term effects of anodal transcranial direct current stimulation on endurance and maximal force production: A systematic review and meta-analysis. Journal of Clinical Medicine, 8(4), 536.
2. Alonzo, A., Brassil, J., Taylor, J. L., Martin, D. & Loo, C. K. (2012). Daily transcranial direct current stimulation (tDCS) leads to greater in- creases in cortical excitability than second daily transcranial direct current stimulation. Brain Stimulation, 5(3), 208-213.
Google Scholar
3. Angius, L., Hopker, J. & Mauger, A. R. (2017). The ergogenic effects of transcranial direct current stimulation on exercise performance. Frontiers in Physiology, 8, 90.
Google Scholar
4. Angius, L., Mauger, A., Hopker, J., Pascual-Leone, A., Santarnecchi, E. & Marcora, S. (2018). Bilateral extracephalic transcranial direct current stimulation improves endurance performance in healthy individuals. Brain Stimulation, 11(1), 108-117.
Google Scholar
5. Barwood, M. J., Butterworth, J., Goodall, S., House, J. R., Laws, R., Nowicky, A. & Corbett, J. (2016). The effects of direct current stimulation on exercise performance, pacing and perception in temperate and hot environments. Brain Stimulation, 9(6), 842-849.
Google Scholar
6. Bornheim, S., Thibaut, A., Beaudart, C., Maquet, P., Croisier, J. L. & Kaux, J. F. (2022). Evaluating the effects of tDCS in stroke patients using functional outcomes: a systematic review. Disability and Rehabili- tation, 44(1), 13-23.
Google Scholar
7. Brunoni, A. R., Nitsche, M. A., Bolognini, N., Bikson, M., Wagner, T., Merabet, L. ... & Pascual-Leone, A. (2012). Clinical research with transcranial direct current stimulation (tDCS): challenges and future directions. Brain Stimulation, 5(3), 175-195.
Google Scholar
8. Callahan, D. M. & Kent-Braun, J. A. (2010). Neural Activation Does Not Mediate Age-Related Reductions in the Torque-Velocity Relation- ship in Healthy Older Adults. Medicine & Science in Sports & Exercise, 42(10), 108-109.
9. Chaieb, L., Antal, A. & Paulus, W. (2008). Gender-specific modulation of short-term neuroplasticity in the visual cortex induced by transcranial direct current stimulation. Visual Neuroscience, 25(1), 77-81.
Google Scholar
10. Chinzara, T., Buckingham, G. & Harris, D. (2021). Transcranial direct cur- rent stimulation (tDCS) and sporting performance: A systematic review and meta-analysis of tDCS effects on physical endurance, muscular strength, and visuomotor skills. The European Journal of Neuroscience.
Google Scholar
11. Cogiamanian, F., Marceglia, S., Ardolino, G., Barbieri, S. & Priori, A. (2007). Improved isometric force endurance after transcranial direct current stimulation over the human motor cortical areas. European Journal of Neuroscience, 26(1), 242-249.
Google Scholar
12. Colzato, L. S., Nitsche, M. A. & Kibele, A. (2017). Noninvasive brain stimulation and neural entrainment enhance athletic performance—a review. Journal of Cognitive Enhancement, 1(1), 73-79.
Google Scholar
13. de Moura, M. C. D. S., Hazime, F. A., Marotti Aparicio, L. V., Grecco, L. A., Brunoni, A. R. & Hasue, R. H. (2019). Effects of transcranial direct current stimulation (tDCS) on balance improvement: a systematic review and meta-analysis. Somatosensory & Motor Research, 36(2), 122-135.
Google Scholar
14. de Paula Simola, R. Á., Raeder, C., Wiewelhove, T., Kellmann, M., Meyer, T., Pfeiffer, M. & Ferrauti, A. (2016). Muscle mechanical properties of strength and endurance athletes and changes after one week of intensive training. Journal of Electromyography and Kinesiology, 30, 73-80.
Google Scholar
15. de Souza, L. M. L., Cabral, H. V., de Oliveira, L. F. & Vieira, T. M. (2018). Motor units in vastus lateralis and in different vastus medialis regions show different firing properties during low-level, isometric knee extension contraction. Human Movement Science, 58, 307-314.
Google Scholar
16. Dumel, G., Bourassa, M. E., Charlebois-Plante, C., Desjardins, M., Doyon, J., Saint-Amour, D. & De Beaumont, L. (2018). Motor learning improvement remains 3 months after a multisession anodal tDCS intervention in an aging population. Frontiers in Aging Neuro- science, 335.
Google Scholar
17. Dutta, A., Krishnan, C., Kantak, S. S., Ranganathan, R. & Nitsche, M. A. (2015). Recurrence quantification analysis of surface electromyo- gram supports alterations in motor unit recruitment strategies by anodal transcranial direct current stimulation. Restorative Neurology and Neuroscience, 33(5), 663-669.
Google Scholar
18. Enoka, R. M. & Duchateau, J. (2016). Translating fatigue to human performance. Medicine and Science in Sports and Exercise, 48(11), 2228.
Google Scholar
19. Eo, E. & Hwang, B. (2017). The Comparison of Contractile Properties between Knee Flexor and Extensor Muscles in Highschool Basket- ball Players using Tensiomyography (TMG). Journal of Sport and Leisure Studies, 387-394.
20. Gálvez, V., Alonzo, A., Martin, D. & Loo, C. K. (2013). Transcranial direct current stimulation treatment protocols: should stimulus intensity be constant or incremental over multiple sessions? International Journal of Neuropsychopharmacology, 16(1), 13-21.
21. Gandevia, S. C. (2001). Spinal and supraspinal factors in human muscle fatigue. Physiological Reviews.
Google Scholar
22. García-Manso, J. M., Rodríguez-Ruiz, D., Rodríguez-Matoso, D., de Saa, Y., Sarmiento, S. & Quiroga, M. (2011). Assessment of muscle fatigue after an ultra-endurance triathlon using tensiomyography (TMG). Journal of Sports Sciences, 29(6), 619-625.
23. Gualano, A., Bozza, T., Lopes De Campos, P., Roschel, H., Dos Santos Costa, A., Luiz Marquezi, M. ... & Herbert Lancha Junior, A. (2011). Branched-chain amino acids supplementation enhances exercise capacity and lipid oxidation during endurance exercise after muscle glycogen depletion. The Journal of Sports Medicine and Physical Fitness, 51(1), 82-88.
Google Scholar
24. Han, G. & Kim, H. (2003). Isokinetic Evaluation of Knee Muscles in Female Youth Group. Korean Journal of Sport Biomechanics, 1-12.
Google Scholar
25. Kan, B., Dundas, J. E. & Nosaka, K. (2013). Effect of transcranial direct current stimulation on elbow flexor maximal voluntary isometric strength and endurance. Applied Physiology, Nutrition, and Meta- bolism, 38(7), 734-739.
Google Scholar
26. Krause, B. & Cohen Kadosh, R. (2014). Not all brains are created equal: the relevance of individual differences in responsiveness to tran- scranial electrical stimulation. Frontiers in Systems Neuroscience, 8, 25.
Google Scholar
27. Lattari, E., Budde, H., Paes, F., Neto, G. A. M., Appolinario, J. C., Nardi, A. E. ... & Machado, S. (2018). Effects of aerobic exercise on anxiety symptoms and cortical activity in patients with panic disorder: a pilot study. Clinical Practice and Epidemiology in Mental Health: CP & EMH, 14, 11.
Google Scholar
28. Liu, J. Z., Zhang, L., Yao, B., Sahgal, V. & Yue, G. H. (2005). Fatigue in- duced by intermittent maximal voluntary contractions is associated with significant losses in muscle output but limited reductions in functional MRI-measured brain activation level. Brain Research, 1040(1-2), 44-54.
Google Scholar
29. Lohr, C., Braumann, K. M., Reer, R., Schroeder, J. & Schmidt, T. (2018). Reliability of tensiomyography and myotonometry in detecting mechanical and contractile characteristics of the lumbar erector spinae in healthy volunteers. European Journal of Applied Physiology, 118(7), 1349-1359.
Google Scholar
30. Loturco, I., Pereira, L. A., Kobal, R., Kitamura, K., Ramírez-Campillo, R., Zanetti, V. ... & Nakamura, F. Y. (2016). Muscle contraction velocity: a suitable approach to analyze the functional adaptations in elite soccer players. Journal of Sports Science & Medicine, 15(3), 483.
Google Scholar
31. Lu, P., Hanson, N. J., Wen, L., Guo, F. & Tian, X. (2021). Transcranial Direct Current Stimulation Enhances Muscle Strength of Non-dominant Knee in Healthy Young Males. Frontiers in Physiology, 12.
Google Scholar
32. Macgregor, L. J., Ditroilo, M., Smith, I. J., Fairweather, M. M. & Hunter, A. M. (2016). Reduced radial displacement of the gastrocnemius medialis muscle after electrically elicited fatigue. Journal of Sport Rehabilitation, 25(3), 241-247.
Google Scholar
33. Macgregor, L. J., Hunter, A. M., Orizio, C., Fairweather, M. M. & Ditroilo, M. (2018). Assessment of skeletal muscle contractile properties by radial displacement: the case for tensiomyography. Sports Medicine, 48(7), 1607-1620.
Google Scholar
34. Machado, D. G. d. S., Unal, G., Andrade, S. M., Moreira, A., Altimari, L. R., Brunoni, A. R. ... & Okano, A. H. (2019). Effect of transcranial direct current stimulation on exercise performance: a systematic review and meta-analysis. Brain Stimulation, 12(3), 593-605.
Google Scholar
35. Martín-Rodríguez, S., Loturco, I., Hunter, A. M., Rodríguez-Ruiz, D. & Munguia-Izquierdo, D. (2017). Reliability and measurement error of tensiomyography to assess mechanical muscle function: A systematic review. The Journal of Strength & Conditioning Research, 31(12), 3524-3536.
36. Martín-San Agustín, R., Medina-Mirapeix, F., Casaña-Granell, J., García-Vidal, J. A., Lillo-Navarro, C. & Benítez-Martínez, J. C. (2020). Tensi- omyographical responsiveness to peripheral fatigue in quadriceps femoris. PeerJ, 8, e8674. doi:10.7717/peerj.8674
37. Mauger, A. R. (2013). Fatigue is a pain—the use of novel neurophysi- ological techniques to understand the fatigue-pain relationship. In (Vol. 4, pp. 104): Frontiers Media SA.
Google Scholar
38. Mendes, B., Firmino, T., Oliveira, R., Neto, T., Cruz-Montecinos, C., Cerda, M. ... & Freitas, S. R. (2020). Effects of knee flexor submaximal isometric contraction until exhaustion on semitendinosus and biceps femoris long head shear modulus in healthy individuals. Scientific Reports, 10(1), 1-8.
Google Scholar
39. Muthalib, M., Kan, B., Nosaka, K. & Perrey, S. (2013). Effects of tran- scranial direct current stimulation of the motor cortex on pre- frontal cortex activation during a neuromuscular fatigue task: an fNIRS study. In Oxygen Transport to Tissue XXXV (pp. 73-79): Springer.
Google Scholar
40. Napadow, V., Dhond, R., Conti, G., Makris, N., Brown, E. N. & Barbieri, R. (2008). Brain correlates of autonomic modulation: combining heart rate variability with fMRI. Neuroimage, 42(1), 169-177.
Google Scholar
41. Nitsche, M. A., Fricke, K., Henschke, U., Schlitterlau, A., Liebetanz, D., Lang, N. ... & Paulus, W. (2003). Pharmacological modulation of cortical excitability shifts induced by transcranial direct current stimulation in humans. The Journal of Physiology, 553(1), 293-301.
Google Scholar
42. Okano, A. H., Fontes, E. B., Montenegro, R. A., Farinatti, P. D. T. V., Cyrino, E. S., Li, L. M. ... & Noakes, T. D. (2015). Brain stimulation modu- lates the autonomic nervous system, rating of perceived exertion and performance during maximal exercise. British Journal of Sports Medicine, 49(18), 1213-1218.
Google Scholar
43. Pageaux, B. (2014). The psychobiological model of endurance per- formance: an effort-based decision-making theory to explain self-paced endurance performance. Sports Medicine, 44(9), 1319.
Google Scholar
44. Paillard, T. & Noé, F. (2020). Does monopedal postural balance differ between the dominant leg and the non-dominant leg? A review. Human Movement Science, 74, 102686.
Google Scholar
45. Papale, A. E. & Hooks, B. M. (2018). Circuit changes in motor cortex during motor skill learning. Neuroscience, 368, 283-297.
Google Scholar
46. Park, S., Ryu, Y. & Kim, K. (2014). Correlation between Balance Ability, Muscle Strength, and Muscle Endurance, in Taekwondo, Soccer, and Gymnastics Athletes. Korean Journal of Sport Biomechanics, 24(1), 85-93.
Google Scholar
47. Perotto, A. O. (2011). Anatomical guide for the electromyographer: the limbs and trunk: Charles C Thomas Publisher.
Google Scholar
48. Pincivero, D., Lephart, S. & Karunakara, R. (1997). Reliability and precision of isokinetic strength and muscular endurance for the quadriceps and hamstrings. International Journal of Sports Medicine, 18(02), 113-117.
Google Scholar
49. Pol, F., Salehinejad, M. A., Baharlouei, H. & Nitsche, M. A. (2021). The effects of transcranial direct current stimulation on gait in patients with Parkinson's disease: a systematic review. Translational Neuro- degeneration, 10(1), 1-19.
Google Scholar
50. Raeder, C., Wiewelhove, T., Simola, R. Á. D. P., Kellmann, M., Meyer, T., Pfeiffer, M. & Ferrauti, A. (2016). Assessment of fatigue and recovery in male and female athletes after 6 days of intensified strength training. The Journal of Strength & Conditioning Research, 30(12), 3412-3427.
Google Scholar
51. Reis, J., Schambra, H. M., Cohen, L. G., Buch, E. R., Fritsch, B., Zarahn, E. ... & Krakauer, J. W. (2009). Noninvasive cortical stimulation enhances motor skill acquisition over multiple days through an effect on consolidation. Proceedings of the National Academy of Sciences, 106(5), 1590-1595.
Google Scholar
52. Robertson, C. V. & Marino, F. E. (2016). A role for the prefrontal cortex in exercise tolerance and termination. Journal of Applied Physiology, 120(4), 464-466.
Google Scholar
53. Rostami, M., Mosallanezhad, Z., Ansari, S., Ehsani, F., Kidgell, D., Nourbakhsh, M. R. ... & Jaberzadeh, S. (2020). Multi-session anodal transcranial direct current stimulation enhances lower extremity functional performance in healthy older adults. Experimental Brain Research, 238(9), 1925-1936.
Google Scholar
54. Russell, M., Goodman, T., Wang, Q., Groshong, B. & Lyeth, B. G. (2014). Gender differences in current received during transcranial electrical stimulation. Frontiers in Psychiatry, 5, 104.
Google Scholar
55. Samani, M. M., Agboada, D., Jamil, A., Kuo, M. F. & Nitsche, M. A. (2019). Titrating the neuroplastic effects of cathodal transcranial direct current stimulation (tDCS) over the primary motor cortex. Cortex, 119, 350-361.
Google Scholar
56. Sánchez-Kuhn, A., Pérez-Fernández, C., Cánovas, R., Flores, P. & Sánchez-Santed, F. (2017). Transcranial direct current stimulation as a motor neurorehabilitation tool: an empirical review. Biomedical Engineering Online, 16(1), 1-22.
57. Senefeld, J., Yoon, T. & Hunter, S. K. (2017). Age differences in dynamic fatigability and variability of arm and leg muscles: Associations with physical function. Experimental Gerontology, 87, 74-83.
Google Scholar
58. Stagg, C. J. & Nitsche, M. A. (2011). Physiological basis of transcranial direct current stimulation. The Neuroscientist, 17(1), 37-53.
Google Scholar
59. Thongsawang, S., Krataithong, T., ChorCharoenying, S., Norchai, P. & Nokkaew, N. (2021). Applying Cordyceps sinensis to Boost Endur- ance Performance in Long-Distance Runners. Journal of Exercise Physiology Online, 24(3), 1-13.
Google Scholar
60. Van Cutsem, J., Marcora, S., De Pauw, K., Bailey, S., Meeusen, R. & Roelands, B. (2017). The effects of mental fatigue on physical per- formance: a systematic review. Sports Medicine, 47(8), 1569-1588.
Google Scholar
61. Vaseghi, B., Zoghi, M. & Jaberzadeh, S. (2014). Does anodal transcranial direct current stimulation modulate sensory perception and pain? A meta-analysis study. Clinical Neurophysiology, 125(9), 1847-1858.
Google Scholar
62. Vitor-Costa, M., Okuno, N. M., Bortolotti, H., Bertollo, M., Boggio, P. S., Fregni, F. & Altimari, L. R. (2015). Improving cycling performance: transcranial direct current stimulation increases time to exhaustion in cycling. PloS One, 10(12), e0144916.
Google Scholar
63. Wan, J. J., Qin, Z., Wang, P. Y., Sun, Y. & Liu, X. (2017). Muscle fatigue: general understanding and treatment. Experimental & Molecular Medicine, 49(10), e384-e384.
Google Scholar
64. Wang, L., Wang, C., Yang, H., Shao, Q., Niu, W., Yang, Y. & Zheng, F. (2022). Halo Sport Transcranial Direct Current Stimulation Improved Muscular Endurance Performance and Neuromuscular Efficiency During an Isometric Submaximal Fatiguing Elbow Flexion Task. Frontiers in Human Neuroscience, 16.
Google Scholar
65. Williams, P. S., Hoffman, R. L. & Clark, B. C. (2013). Preliminary evidence that anodal transcranial direct current stimulation enhances time to task failure of a sustained submaximal contraction. PloS One, 8(12), e81418.
Google Scholar
66. Workman, C. D., Fietsam, A. C. & Rudroff, T. (2020). Transcranial direct current stimulation at 4 mA induces greater leg muscle fatigability in women compared to men. Brain Sciences, 10(4), 244.
Google Scholar
67. Workman, C. D., Kamholz, J. & Rudroff, T. (2019). The tolerability and efficacy of 4 mA transcranial direct current stimulation on leg muscle fatigability. Brain Sciences, 10(1), 12.
Google Scholar
68. Yavari, F., Jamil, A., Samani, M. M., Vidor, L. P. & Nitsche, M. A. (2018). Basic and functional effects of transcranial electrical stimulation (tES)—an introduction. Neuroscience & Biobehavioral Reviews, 85, 81-92.
69. Zhang, R., Lam, C. L., Peng, X., Zhang, D., Zhang, C., Huang, R. & Lee, T. M. (2021). Efficacy and acceptability of transcranial direct current stimulation for treating depression: A meta-analysis of randomized controlled trials. Neuroscience & Biobehavioral Reviews, 126, 481-490.
Google Scholar